微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (11分)碳是组成物质种类最多的元素。
(1)碳元素在元素周期表中的位置是第?周期?族。
碳有612C、613C、614C三种原子,它们互称为?。
(2)金刚石、石墨、C60三种碳单质互称为?。
C60的晶体类型是?,金刚石中碳原子的轨道杂化方式是?,
石墨晶体中存在的作用力有?。
(3)利用碳的低价氧化物CO可以合成化工原料COCl、配合物Fe(CO)5等。
①COCl分子的结构式为 ,分子中C原子的杂化轨道方式是_____________;按原子轨道重叠方式判断COCl分子中的化学键类型为___________________。
,分子中C原子的杂化轨道方式是_____________;按原子轨道重叠方式判断COCl分子中的化学键类型为___________________。
②Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断Fe(CO)5的晶体类型为?;Fe(CO)5在一定条件下发生分解反应:Fe(CO)5 ==Fe(s)+5CO,反应过程中,断裂的化学键只有配位键。形成的化学键是_______________。
金属铁单质的晶体在不同温度下有两种堆积方式,晶胞如图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为?。
参考答案:

本题解析:略
本题难度:一般
2、选择题 在下列实验中,不能达到目的的是(?)
A.用金属钠分别与水和乙醇反应,确定水和乙醇分子中羟基氢(-OH)的活泼性强弱
B.用石墨作电极,电解Mg(NO3)2、Cu(NO3)2的混合溶液,确定铜和镁的金属活动性强弱
C.进行H2O和H2S 的热分解实验,确定硫和氧两种元素的非金属性强弱
D.根据Na2CO3和Na2SO3水溶液酸碱性强弱,确定碳和硫两元素非金属性的强弱
参考答案:D
本题解析:D不正确,应该是最高价氧化物的水化物的钠盐,答案选D。A、正确,金属钠和乙醇反应慢;B、电解中,铜析出,镁的金属活动性强。C、正确,H2S 易分解,硫非金属性弱;
本题难度:一般
3、选择题 下表是元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
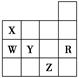
A.常压下五种元素的单质中Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物还原性小于Y的氢化物
D.Y元素的非金属性比W元素的非金属性强
参考答案:D
本题解析:本题考查了元素周期表以及元素“位、构、性”之间的关系。根据图表判断出X、Y、Z、W、R对应的元素为N、S、Br、P、Ar。S、P元素的单质为固态,单质溴为液态,A错;S2-有3个电子层,Br-有4个电子层,故B错;非金属性越强,其气态氢化物的还原性越弱,故C错;同周期中原子序数越大,元素的非金属性越强,故选D。
本题难度:一般
4、选择题 X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大。X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层电子数与其电子层数相等,Z—与M2+具有相同的核外电子层结构。下列推测正确的是?(?)
A.原子半径Y>Z,离子半径Z—<M2+
B.MX2与水发生反应时,MX2只做氧化剂
C.X、Y形成的化合物既能与强酸反应又能与强碱反应
D.MX2、MZ2两种化合物中,都含有离子键和共价键,且阳离子与阴离子个数比均为1:2
参考答案:C
本题解析:根据题意可知:X是O;Y是Al;Z是Cl;M是Ca。A.Al、Cl是同一周期的元素,原子序数越大,原子半径就越小,所以原子半径Al>Cl;Cl-、Ca2+是电子层结构相同的微粒。原子序数越大,离子半径就越小。所以离子半径Cl—>Ca2+.错误。B.在2CaO2+2H2O=2Ca(OH)2+ O2↑中CaO2做氧化剂、还原剂。错误。C. Al2O3是两性氧化物,既能与酸反应产生盐和水,也能与碱反应产生盐和水。正确。D.在CaO2中含有离子键、非极性共价键,阳离子与阴离子个数比1:1;而在CaCl2中含有离子键, 阳离子与阴离子个数比1:2;错误。
本题难度:简单
5、填空题 (16分)下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:
(除特别注明外,其它一律用化学式表示)
A
| ?
| ?
|
?
| ?
| ?
| ?
| W
| T
| M
| ?
| ?
|
B
| D
| ?
| Z
| J
| L
| U
| V
| R
|
X
| E
| ?
| ?
| ?
| ?
| ?
| Y
| ?
| ?
| G
| ?
| ?
| ?
| ?
| ?
| Q
| ?
|
| | | | | | | | | | | | | | | | |
|
(1)化学性质最不活泼的单质是 ,金属氢氧化物中碱性最强的是?,
属于过渡元素的是 ?(填字母),J在周期表中的位置?。
(2)A 分别和L、M、T形成的化合物稳定性强弱顺序 ??> ? > ? ,
L、U、V的最高价氧化物对应水化物的酸性强弱顺序 ??> ? > ?。
(3)V、Q形成的简单阴离子还原性强弱顺序 ??> ? ,
D、M、U、V形成的简单离子半径大小顺序 ?> ?> ?> ?。
(4)写出Z、B分别形成的最高价氧化物对应水化物相互反应的离子方程式:
?。
(5)已知G为常见的红色金属单质,现取7.68g G和50 mL 的浓硝酸反应,当G反应完毕时,溶液体积基本不变,共收集到气体的体积是3.36 L(标准状况,不考虑N2O4),剩余溶液中c(H+)=" 2.2" mol/L,则原硝酸溶液的浓度为?。
参考答案:(1)Ar? KOH? YG?第三周期ⅣA
(2)H2O>NH3>PH3?HClO4>H2SO4>H3PO4
(3)Br->Cl-? S2->Cl->O2->Mg2+
(4)Al(OH)3+ OH-=AlO2 -+2H2O?(5)10 mol/L
本题解析:依题意可知分别为H、C、N、O、Na、Mg、Al、Si、P、S、Cl、Ar、K、Ca、Fe、Cu、Br,化学性质最不活泼的单质是零族元素,碱性最强的为KOH,H2O>NH3>PH3?HClO4>H2SO4>H3PO4,Br->Cl-? S2->Cl->O2->Mg2+?Al(OH)3+ OH-=AlO2 -+2H2O
(5)由守恒法算出C(HNO3)=10 mol/L
本题难度:一般