微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题
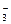
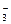
A.R原子的电子层数比N的电子层数多1
B.RO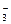 中R的化合价与NO
中R的化合价与NO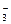 中N的化合价相等
中N的化合价相等
C.RO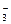 和NO
和NO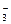 只能被还原,不能被氧化
只能被还原,不能被氧化
D.R和N为同族元素
参考答案:AB
本题解析:酸根RO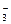 所含电子数为42,其中R原子内所含电子数为42-24-1=17,故R为氯元素,RO
所含电子数为42,其中R原子内所含电子数为42-24-1=17,故R为氯元素,RO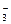 为ClO
为ClO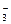 ,其中Cl的价态为+5,既能被氧化,又能被还原。
,其中Cl的价态为+5,既能被氧化,又能被还原。
本题难度:简单
2、填空题 (6分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族
周期
| IA
| ?
| 0
|
1
| ①
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| ?
|
2
| ?
| ?
| ?
| ②
| ③
| ④
| ?
| ?
|
3
| ⑤
| ?
| ⑥
| ⑦
| ?
| ?
| ⑧
| ?
|
(1)④、⑤、⑥的原子半径由大到小的顺序为______。
(2)②、⑧、⑦的最高价含氧酸的酸性由强到弱的顺序是______。
(3)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2?b.FeCl3? c.Na2SO3 d.KMnO4
参考答案:(1)Na>Al>O? (2分)(2)HNO3>H2CO3>H2SiO3?(2分)(3)a b? (2分)
本题解析:(1)④、⑤、⑥的原子半径由大到小的顺序为:Na>Al>O
(2)②、⑧、⑦的最高价含氧酸的酸性由强到弱的顺序是:HNO3>H2CO3>H2SiO3
(3)常见液态化合物为双氧水,双氧水分解可使用的催化剂为MnO2、FeCl3。故选a b
本题难度:简单
3、选择题 下列说法正确的是?(?)
A.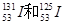 互称同位素
互称同位素
B.NH3的摩尔质量为17
C.醋酸是强电解质
D.分解反应一定不是氧化还原反应
参考答案:A
本题解析:A正确,同位素是指质子数相同而中子数不同的同一元素的不同原子;B错,摩尔质量的单位为g/mol;C错,醋酸为弱电解质;D错,有单质生成的分解一定是氧化还原反应;
本题难度:简单
4、选择题 如下图所示为各元素周期表中的一部分,表中数字是原子序数,其中X为35的是( )

参考答案:A
本题解析:在元素周期表中上下对应位置,一二周期的原子序数相差2或8.二三周期相差8,三四周期相差8或18,三四周期相差18或32.左右相邻原子序数相差1故A选项是正确的。
本题难度:一般
5、填空题 已知五种短周期元素的原子序数大小顺序为C>A>B>D>E, A、C同周期,B、C同主族。A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:
(1)写出E和B形成的化合物分子含非极性共价键的结构式:____________________;?
写出A、B、E形成的化合物的电子式:______________。
(2)比较A、B、C三种离子的半径大小_________________(用离子符号表示)。
(3)写出均由A、B、C、E四种元素组成的二种化合物相互反应的离子方程式?
参考答案:(1) H-O-O-H? NaOH电子式: ?(2)S2-﹥O2-﹥Na+?(3)H++HSO3-=H2O+SO2 ↑
?(2)S2-﹥O2-﹥Na+?(3)H++HSO3-=H2O+SO2 ↑
本题解析:(1)短周期元素的原子序数大小顺序为C>A>B>D>E,D和E可形成4核10电子的分子。则D是N,E是H.。 A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;A是Na,B是O. B、C同主族。短周期元素中原子序数C>A>B,C是S。即A:Na,B:O.C:S,D:N,E:H.。所以E和B形成的化合物过氧化氢分子含非极性共价键的结构式:H-O-O-H。A、B、E形成的化合物NaOH的电子式:
(2)S2-有3个电子层,Na+、O2-都有2个电子层,对于电子层不同的离子,离子的电子层越多,离子半径越大;对于电子层相同的离子,核电荷数越大,离子半径越小。所以这三种离子半径大小为: S2-﹥O2-﹥Na+(3)有Na、O、S、H.四种元素组成的化合物是NaHSO4 和NaHSO3.它们发生反应的化学方程式是NaHSO4 +NaHSO3=Na2SO4+H2O+SO2↑.离子方程式为:H++HSO3-=H2O+SO2 ↑。
本题难度:一般