微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知两种弱酸HA、HB的电离平衡常数Ka(HA)>Ka(HB)。下列有关说法正确的是
A.等温浓度均为0.1 mol·L-1的HA、HB溶液中,其溶液的pH大小为:pH(HA)>pH(HB)
B.在0.1mol·L-1的NaA溶液中各离子浓度关系为:c(Na+)>c(A-)>c(OH-)>c(H+)
C.等体积pH相同的HA、HB溶液,分别加入等浓度的NaOH溶液,恰好完全反应消耗的NaOH溶液体积HA比HB多
D.等温浓度均为0.1 mol·L-1的NaA、NaB溶液中,其溶液的pH大小为:pH(NaA)>pH(NaB)
参考答案:B
本题解析:电离平衡常数越大,酸越强,相应的钠盐水解程度就小,所以AD不正确,B正确.pH相同时,HB的浓度大,则消耗的氢氧化钠多,C不正确。答案选B。
本题难度:一般
2、选择题 25℃时不断将水滴入0.1mol/L的氨水中,下列图像变化合理的是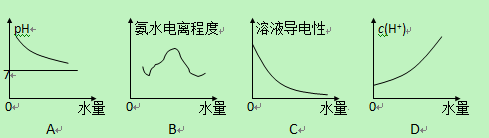
参考答案:AC
本题解析:
选AC。
稀释时氢氧根离子浓度下降,pH下降,趋近于7,A对;电离度始终增大,B错;离子浓度下降,导电能力下降,C对;氢氧根离子浓度下降,氢离子浓度增大,最后基本不变,D错
本题难度:一般
3、选择题 下列说法或表示方法中正确的是
[? ]
A.等质量的硫蒸气和硫磺分别完全燃烧,后者放出的热量多
B.反应热的大小与反应物的多少无关
C.已知强酸与强碱反应的中和热为57.3 kJ·mol-1,若将含0.5mol H2SO4的浓溶液与含1mol NaOH的溶液混合,放出的热量要大于57.3 kJ
D.Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(s)+2NH3(g)+10H2O(l);△H<0
参考答案:C
本题解析:
本题难度:一般
4、选择题 MOH和ROH两种碱的溶液分别加水稀释时,pH变化如图所示。下列叙述中正确的是(?)
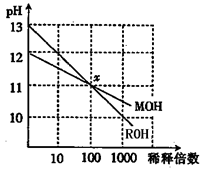
A.MOH是一种强碱
B.在x点,MOH完全电离
C.在x点,c(M+)==c(R+)
D.稀释前,c(ROH)==10c(MOH)
参考答案:C
本题解析:A.ROH是一种强碱,MOH为弱碱;
B.在x点,MOH和ROH溶液pH值相同;
D.稀释前,c(ROH中的OH-)==10c(MOH中的OH-);
本题难度:一般
5、选择题 常温下,用0.1000 mol/L NaOH溶液分别滴定20.00mL 0.1000 mol/L盐酸和20.00 mL 0.1000 mol/L醋酸溶液,得到2条滴定曲线,如下图所示:
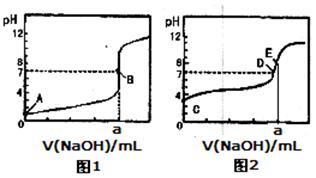
以HA表示酸,下列说法正确的是
A.滴定盐酸的曲线是图2
B.达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A—)
C.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D.当0mL< V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)>c(Na+)>c(H+)>c(OH-)
参考答案:B
本题解析:因为滴定终点时NaCl溶液为中性,CH3COONa溶液为碱性,故滴定盐酸的曲线是图1,A错,相同的NaOH中和相同的酸C错;达到B、D状态时的pH=7,c(H+)=c(OH—),根据溶液的电荷守恒,c(Na+)=c(A—),B正确;在醋酸溶液中滴定NaOH,pH=7时,0mL< V(NaOH)<20.00mL,但有:c(A-)=c(Na+)>c(H+)=c(OH-),D不正确。
本题难度:一般