微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 25?℃时,在25?mL?0.1?mol/L的NaOH溶液中逐滴加入0.2 mol/L CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论正确的是

A.a=12.5,且混合溶液pH=7
B.对应曲线上E、F之间的任何一点,溶液中都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.P点时,c(CH3COO-)>c(Na+)>c(H+)=c(OH-)
D.K点时,c(CH3COO-)+c(CH3COOH)=2c(Na+)
参考答案:D
本题解析:略
本题难度:一般
2、选择题 已知25 ℃时有关弱酸的电离平衡常数如下表:
弱酸的化学式
| CH3COOH
| HCN
| H2CO3
|
电离平衡常数(25℃)
| 1.8×10-5
| 4.9×10-10
| K1=4.3×10-7
K2=5.6×10-11
|
则下列有关说法正确的是
A.各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)
B.a mol·L-1HCN溶液与b mol·L-1NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b
C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO)+2c(CO)
参考答案:D
本题解析:根据弱酸的电离平衡常数可知,酸性强弱顺序是CH3COOH>H2CO3>HCN>HCO。由于酸越弱,相应的钠盐越容易水解,pH越大。A不正确,因为溶液的浓度不一定是相同的;根据溶液中电荷守恒可知c(Na+)+c(H+)=c(OH-)+c(CN-),由于所得溶液中c(Na+)>c(CN-),所以c(H+)<c(OH-),因此溶液显碱性,但当二者恰好反应时,生成的盐水解,溶液也是显碱性的,但此时a=b,所以选项B不正确;稀释是一直促进电离的,C不正确,且pH是先减小或增大;根据电荷守恒可知,选项D正确,答案选D。
点评:在比较溶液中离子浓度时,应该利用好3个守恒关系式,即电荷守恒、物料守恒和质子守恒。
本题难度:一般
3、选择题 某混合溶液中所含离子的物质的量浓度如下表,则M可能为( )
| 所含离子 | NO3- | SO42- | H+ | M
物质的量浓度(mol?L-1)
2
1
2
1
|
A.Mg2+
B.Ba2+
C.F-
D.Na+
参考答案:因溶液不显电性,设M离子的电荷为x,由电荷守恒可知,
2×1+1×2=1×2×x×1,
解得x=+2,
则可能为A或B,
又SO42-与Ba2+能结合生成硫酸钡沉淀,不能共存,
则溶液中存在的离子为Mg2+,
故选A.
本题解析:
本题难度:一般
4、选择题 某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是
A.Cl-、Mg2+、H+、Zn2+、SO
B.Na+、Ba2+、NO3-、OH 、SO
、SO
C.K+、NO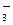 、SO
、SO 、OH-、Na+
、OH-、Na+
D.MnO 、K+、Cl-、H+、SO
、K+、Cl-、H+、SO
参考答案:AC
本题解析:【分析预测及备考建议】离子共存问题、离子反应能否发生、离子方程式的书写、离子浓度大小(包括溶液酸碱性)的比较等问题是高考久考不衰的热点题型。不共存的可能有:
1.由于发生复分解反应,离子不能大量共存
2.由于发生氧化还原反应,离子不能大量共存
3.能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存
4.溶液中能够发生络合反应的离子不能大量共存。如:Fe3+与SCN-不能大量共存
今后命题的发展的方向是:(1)增加限制条件如强酸性、无色透明、碱性、PH=1、甲基橙呈红色、发生氧化还原反应等(2)定性中有定量,如由水电离出的C(H+)1*10-14mol·L-1的溶液……
【答题技巧】A项中的离子能共存,且H+能与HCO3-反应生成气体;B中的Ba2+与SO42-不能共存;C项中离子间能共存;D中的MnO4-是一种紫色的离子,不合题意,且OH-能与NH4+反应生成NH3气体,所以正确答案为AC。
本题难度:一般
5、选择题 无色溶液中,下列各组离子能大量共存的是( )
A.SO32一、Cl一、Na+、ClO一
B.K+、AlO2一、NO3一、Cr2O72一
C.H+、Cl一、SO42一、S2O32一
D.SiO32一、Na+、CO32一、K+
参考答案:A.因SO32-、ClO-能发生氧化还原反应,则不能共存,故A错误;
B.因Cr2O72-在水溶液中为红色,与无色溶液不符,故B错误;
C.因H+、S2O32-能结合生成S和气体,则不能共存,故C错误;
D.应该组离子之间不反应,则能够共存,故D正确;
故选D.
本题解析:
本题难度:一般