微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知T℃,PkPa时,在容器甲和容器乙中分别充入1mo1A(g)和1 molB(g),发生反应A(g)+B(g) C(g) DH<0,反应过程中温度保持不变。已知起始时V乙
C(g) DH<0,反应过程中温度保持不变。已知起始时V乙
 V甲,装置如下图所示。当反应达平衡时,测得甲中C的体积分数为40%。下列说法中不正确的是
V甲,装置如下图所示。当反应达平衡时,测得甲中C的体积分数为40%。下列说法中不正确的是
 ?
?
A.容器甲、乙中反应的起始速率不等
B.达平衡时,容器甲、乙中各组分的体积分数不等
C.达平衡时,容器甲、乙中放出的热量相等
D.达平衡时,容器乙中再充入少量稀有气体,A的转化率不变
参考答案:B
本题解析:
通过达平衡时甲中C的体积分数可计算平衡时容器甲的体积,设A的转化率为x,
A(g)?+ B(g)? ?C(g) ?H<0
?C(g) ?H<0
起始:1 mol? 1 mol? 0
转化:xmol?xmol?xmol
平衡:(1-x)mol? (1-x)mol?xmol
40%== ,解得x
,解得x
 mol,反应后气体的总物质的量为
mol,反应后气体的总物质的量为 mol,容器的容积为原来的
mol,容器的容积为原来的 ,现由于起始时V乙
,现由于起始时V乙
 V甲,且投料量相同,所以V甲和
V甲,且投料量相同,所以V甲和
V乙二种状态属于等效平衡,因此B错。
本题难度:一般
2、填空题 (6分)在密闭容器中进行如下反应:mA(g)+nB(g)  pC(g),反应经5 min达到平衡,测得此时A的浓度减小了a mol·L-1,而C的浓度增加了2/3a mol·L-1,又知平均反应速率v(C)=2v(B)。
pC(g),反应经5 min达到平衡,测得此时A的浓度减小了a mol·L-1,而C的浓度增加了2/3a mol·L-1,又知平均反应速率v(C)=2v(B)。
(1)写出上述化学方程式中各物质的计量数:m=________,n=________,p=________
(2)压强一定时,C的百分含量(C%)与温度、时间(T表示温度,t表示时间)的关系如图所示。由此可知,该反应为 ?(填“吸热”或“放热”)反应。

(3)该反应的平衡常数表示式为 ,升高温度,K值将 (填“增大”、“减小”或“不变”)。
参考答案:(6分):(1)3 1 2(每空1分) (2)放热(1分)
(3)K=c2(C)/c3(A).c(B)?(2分)减小(2分)
本题解析:(1)平均反应速率v(C)=2v(B),所以B的浓度减少了1/3amol/L。根据变化量之比是相应的化学计量数之比可知,m︰n︰p=3︰1︰2,所以m=3,n=1,p=2。
(2)根据图像可知,T1首先达到平衡状态,所以温度是T1大于T2。温度高,C的百分含量低,说明升高温度平衡向逆反应方向进行,所以正反应是放热反应。
(3)平衡常数是在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以平衡常数的表达式是K=c2(C)/c3(A).c(B);升高温度平衡向逆反应方向进行,,所以平衡常数是减小的。
本题难度:一般
3、选择题 在溶液中发生的反应,对反应速率不发生影响的因素是
A.温度
B.压强
C.浓度
D.催化剂
参考答案:B
本题解析:
本题难度:简单
4、选择题 碘钨灯比白炽灯使用寿命长。灯管内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W(s)+I2(g)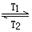 WI2(g)?ΔH<0(温度T1<T2)。下列说法正确的是
WI2(g)?ΔH<0(温度T1<T2)。下列说法正确的是
A.灯管工作时,扩散到灯丝附近高温区的WI2(g)会分解出W,W重新沉积到灯丝上
B.灯丝附近温度越高,WI2(g)的转化率越低
C.该反应的平衡常数表达式是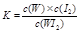
D.利用该反应原理可以提纯钨
参考答案:AD
本题解析:依题意,T1低于T2,高温时WI2(g)分解为W(s)和I2(g),故A项正确;焓变小于0,说明正反应是放热反应,升高温度,有利于WI2(g)分解,温度越高,WI2(g)越容易分解,WI2(g)的转化率越高,故B项错误;固体物质不能写入平衡表达式,因为其浓度是常数,根据平衡常数定义可知,K=c(WI2)/c(I2),故C项错误;根据该反应原理,粗钨置于低温区,在较低温度时与I2(g)发生化合反应,生成的WI2(g)扩散到高温区时,发生分解反应,生成纯净的W(s)留在高温区,而I2(g)扩散到低温区继续与粗钨循环反应,因此可以提纯钨,故D项正确。
本题难度:一般
5、选择题 将1molCO和1molNO2充入密闭容器中,在催化剂存在下发生反应 NO?2(g)+CO(g) CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中CO2的体积分数是(?)
CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中CO2的体积分数是(?)
A.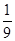
B.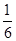
C.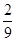
D.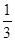
参考答案:
本题解析:C? NO?2(g)+CO(g) CO2(g)+NO(g)
CO2(g)+NO(g)
起始量(mol)? 1? 1? 0? 0
转化量(mol)? 0.5? 0.5? 0.5? 0.5
平衡量(mol)? 0.5? 0.5? 0.5? 0.5
则平衡常数K=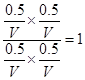
NO?2(g)+CO(g) CO2(g)+NO(g)
CO2(g)+NO(g)
起始量(mol)? 1? 2? 0? 0
转化量(mol)? x? x? x? x
平衡量(mol) (1-x)(2-x)? x? x
则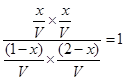
解得x=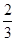
所以反应达到化学平衡时,混合气体中CO2的体积分数是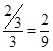
答案选C。
点评:该题是基础性试题的考查,难度不大。该题学生需要明确的是做这类试题的基本要求,即在进行可逆反应的有关计算时,一般采用“三段式”进行,即分别列出起始量、转化量和平衡量或某深刻的量,然后依据已知条件列式计算即可。该题有利于培养学生的规范答题能力。
本题难度:简单