微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 工业上电解饱和食盐水可得到多种工业原料,其中氢气和氯气用途非常广泛.
(1)如图所示是离子交换膜(允许钠离子通过,不允许氢氧根与氯离子通过)法电解饱和食盐水示意图.电解过程中,A极发生的是______(填“氧化”或“还原”)反应;B极的电极反应方程式为______.若将电极材料换为铁棒,则B极的电极反应为______.
(2)以上反应得到的H2和C12可直接化合制盐酸.有人设想利用原电池原理直接制备盐酸,同时获得电能.若这种设想可行,则通氢气的电极为______极;通氯气的电极反应式为______.
(3)工业制得的浓盐酸往往呈黄色,原因是输送氯气的铁管道被腐蚀所致.请写出有关反应的化学方程式______,这种腐蚀属于______.
(4)室温下,将1.000mo1?L-1盐酸滴入20.00mL1.000mo1?L-1氨水中,当溶液pH=7时,c(C1-)______c(NH4+)(填=、>、<);当滴入20.00mL盐酸时,溶液中各离子浓度由大到小的顺序为______.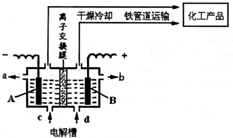
参考答案:(1)由图可知,A为阴极生成氢气,发生还原反应,而B为阳极,该电极反应为2C1--2e=C12↑;若将电极材料换为铁棒,B为阳极,金属失去电子,电极反应为Fe-2e=Fe2+,
故答案为:还原;2C1--2e=C12↑;Fe-2e=Fe2+;
(2)由H2+C12═2HCl,H元素的化合价升高,则通氢气为负极,Cl元素的化合价降低,则通氯气为正极,该正极反应为C12+2e=2Cl-,
故答案为:负;C12+2e=2Cl-;
(3)浓盐酸往往呈黄色,是因混有Fe3+,发生Fe被氧化的化学反应,反应为2Fe+3C12=2FeC13,属于化学腐蚀,故答案为:2Fe+3C12=2FeC13;化学腐蚀;
(4)pH=7时,c(H+)=c(OH-),由电荷守恒可知,c(OH-)+c(C1-)=c(NH4+)+c(H+),则c(C1-)=c(NH4+),当滴入20.00mL盐酸时,恰好生成氯化铵,铵根离子水解显酸性,所以离子浓度的关系为c(C1-)>c(NH4+)>c(H+)>c(OH-),
故答案为:=;c(C1-)>c(NH4+)>c(H+)>c(OH-).
本题解析:
本题难度:一般
2、选择题 下列物质中都含有氢元素,按照已学知识判断其中属于酸的是
A.NH3
B.CH4
C.NaHCO3
D.HClO3
参考答案:D
本题解析:电离的阳离子全部是氢离子的是算,故
本题难度:简单
3、选择题 把三氯化铁溶液蒸干灼烧,最后得到的固体产物是( )
A.无水三氯化铁
B.氢氧化铁
C.氧化亚铁
D.三氧化二铁
参考答案:D
本题解析:
本题难度:简单
4、选择题 用惰性电极电解M(NO3)x的水溶液,当阴极上增重ag时,阳极上同时产生bL(标准状况)氧气,从而可知M的相对原子质量为
A.22.4ax/b
B.11.2ax/b
C.5.6ax/b
D.2.5ax/b
参考答案:C
本题解析:
本题难度:困难
5、选择题 对下列各溶液中,微粒的物质的量浓度关系表述正确的是
[? ]
A.?某溶液中存在的离子只有Cl-、OH-、NH4+、H+,该溶液中离子浓度大小关系可能为
c(Cl-)>c(NH4+)?>c(OH-)>c(H+)
B.?在NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
C.?将相同物质的量浓度的某弱酸(A-为弱酸根)溶液与KA溶液等体积混匀,测得混合后溶液pH=10,则混合液中c(K+)>c(A-)
D.?0.1?mol·L-1?CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
参考答案:C
本题解析:
本题难度:一般