微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,下列各组离子在指定溶液中一定能大量共存的是
A.能使甲基橙试液显红色的溶液中:Na+、NH4+、I-、NO3-
B.含有0.1?mol?L-1Fe3+的溶液中:K+、Mg2+、I-、SO42-
C.由水电离出来的c(H+)=1×10-13?mol?L-1的溶液中:K+、CO32-、Cl-、NO3-
D.常温下,=0.1?mol?L-1的溶液:Na+、K+、CO32-、NO3-
参考答案:D
本题解析:分析:A.能使甲基橙试液显红色的溶液,显酸性;
B.Fe3+、I-发生氧化还原反应;
C.由水电离出来的c(H+)=1×10-13?mol?L-1的溶液,为酸或碱溶液;
D.常温下,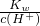 =0.1?mol?L-1的溶液,c(OH-)=0.1mol/L,溶液显碱性.
=0.1?mol?L-1的溶液,c(OH-)=0.1mol/L,溶液显碱性.
解答:A.能使甲基橙试液显红色的溶液,显酸性,氢离子与I-、NO3-发生氧化还原反应,则不能共存,故A错误;
B.Fe3+、I-发生氧化还原反应,则不能共存,故B错误;
C.由水电离出来的c(H+)=1×10-13?mol?L-1的溶液,为酸或碱溶液,酸溶液中氢离子与CO32-反应,则不能共存,故C错误;
D.常温下,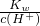 =0.1?mol?L-1的溶液,c(OH-)=0.1mol/L,溶液显碱性,该组离子之间不反应,则能够共存,故D正确;
=0.1?mol?L-1的溶液,c(OH-)=0.1mol/L,溶液显碱性,该组离子之间不反应,则能够共存,故D正确;
故选D.
点评:本题考查离子的共存,明确发生的复分解反应是解答本题的关键,并熟悉离子之间的反应来解答,题目难度不大.
本题难度:简单
2、填空题 工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) 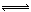 CH3OH(g)。
CH3OH(g)。
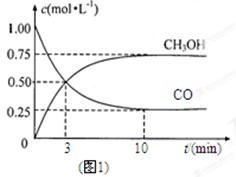
(1)图1是表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)= ; H2的平衡转化率为_________________________。
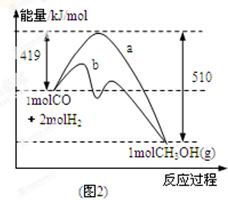
(2)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。写出反应的热化学方程式 。
(3)该温度下,反应平衡常数K=______________(填数值),温度升高,平衡常数K_________(填“增大”、“不变”或“减小”)。
(4)恒容条件下,下列措施中能使反应体系中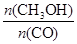 增大的措施有 。
增大的措施有 。
a.升高温度 b.充入He气 c.再充入2 molH2 d.使用催化剂
参考答案:(11分)
(1)0.075mol·L-1·min-1(2分) 0.75(或75%)(2分)
(2)CO(g) + 2H2(g)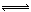 CH3OH(g) ΔH=-91 kJ·mol-1(2分)
CH3OH(g) ΔH=-91 kJ·mol-1(2分)
(3)4 mol-2·L-2(2分) 减小 (1分)
(4)C(2分)
本题解析:(1)由图可知,CO浓度变化量为1.00mol/L-0.25mol/L=0.75mol/L,△t=10min,则v(CO)=0.75mol/L÷10min=0.075mol/(L?min),氢气的平衡转化率为1.5/2=0.75。
(2)反应物的总能量为419kJ,生成物的总能量为510kJ,则该反应为放热反应,放出的热量为419kJ-510kJ=91kJ,热化学方程式为CO(g)+2H2(g)=CH3OH(g)△H=-91 kJ/mol,该反应使用催化剂,只能改变反应的途径降低反应所需的活化能,而不能改变反应热,故答案为:放热;CO(g)+2H2(g)=CH3OH(g)△H=-91 kJ/mol;不能;
(3) CO(g)+2H2(g)?CH3OH(g)
初始浓度(mol/L): 1 2 0
转化浓度(mol/L): 0.75 1.5 0.75
平衡浓度(mol/L): 0.25 0.5 0.75
平衡常数K="0.75/(0.75" ×0.52 )=4mol-2·L-2
因该反应为放热反应,则升高温度,化学平衡逆向移动,K值减小;
(4)使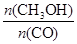 增大,化学平衡应正向移动,但升高温度时化学平衡逆向移动,恒容条件下充入He气化学平衡不移动,使用催化剂化学平衡不移动,在恒容条件下再充入1molCO和2molH2,压强增大,化学平衡正向移动,符合题意,故c正确,故答案为:c。
增大,化学平衡应正向移动,但升高温度时化学平衡逆向移动,恒容条件下充入He气化学平衡不移动,使用催化剂化学平衡不移动,在恒容条件下再充入1molCO和2molH2,压强增大,化学平衡正向移动,符合题意,故c正确,故答案为:c。
考点:本题考查的是化学原理知识,涉及化学反应速率计算、转化率计算、平衡常数的计算、热化学方程式的书写、平衡常数的应用等。
本题难度:困难
3、选择题 化学键的断裂和形成的观点不能用于解释下列化学事实中的( )
A.氧化还原反应
B.化学反应的能量变化
C.加成反应
D.化学反应过程的本质
参考答案:A、有电子转移的反应是氧化还原反应,所以不能用化学键的断裂和形成的观点解释,故A符合;
B、断裂化学键需要吸收能量,形成化学键放出能量,所以有化学反应的能力变化就一定有化学键的断裂和形成,所以可用化学键的断裂和形成的观点解释,故B不符合;
C、有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应,所以加成反应可用化学键的断裂和形成的观点解释,故C不符合;
D、化学反应的本质是:旧化学键的断裂和新化学键的形成,只要有旧化学键的断裂和新化学键的形成就一定发生化学反应,所以可用化学键的断裂和形成的观点解释,故D不符合;
故选A.
本题解析:
本题难度:简单
4、选择题 已知CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-Q1①
2H2(g)+O2(g)===2H2O(g) ΔH=-Q2 ② H2O(g)===H2O(l) ΔH=-Q3③
常温下,取体积比为4∶1的甲烷和H2的混合气体112 L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为( )
A.4Q1+0.5Q2
B.4Q1+Q2+10Q3
C.4Q1+2Q2
D.4Q1+0.5Q2+9Q3