微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
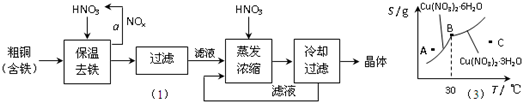
1、简答题 (1)工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:
①在步骤a中,还需要通入氧气和水,其目的是______.
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在______范围.
| ? | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH
Fe3+
Cu2+
1.9
4.7
3.2
6.7
|
不用加水的方法调节溶液pH的原因是______.
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明)______.
(2)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是______.
(3)图是某小组同学查阅资料所绘出的硝酸铜晶体[Cu(NO3)2?nH2O]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是______(填字母).
a.A点时的溶液为不饱和溶液
b.B点时两种晶体可以共存
c.按上述流程最终得到的晶体是Cu(NO3)2?3H2O
d.若将C点时的溶液降温至30℃以下,可以析出Cu(NO3)2?6H2O晶体
(4)某些共价化合物(如H2O、NH3、N2O4等)在液态时有微弱的导电性,主要是因为发生了电离,如:2NH3

NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是______;Cu与液态N2O4反应制得无水硝酸铜的化学方程式是______.
参考答案:(1)①氮氧化物与水和氧气发生氧化还原反应最终生成硝酸,在步骤a中,需要通入氧气和水,有利于提高原料的利用率,减少污染物的排放;
故答案为:提高原料的利用率,减少污染物的排放;
②向溶液中加入CuO,调节溶液的pH目的是铁离子全部沉淀,铜离子不沉淀,依据图表数据分析可知PH应为:3.2~4.7;Fe3+易水解,为利用溶液的蒸发浓缩,应尽量用浓溶液,即加水会将溶液稀释,不利于将滤液蒸发浓缩,
故答案为:3.2~4.7;加水会将溶液稀释,不利于将滤液蒸发浓缩;
③硝酸铜溶液中存在:Cu2++2H2O?Cu(OH)2+2H+,进行蒸发浓缩时,要用硝酸调节溶液的pH=1,可以抑制硝酸铜的水解,有利用硝酸铜晶体的析出,
故答案为:由于Cu2+发生水Cu2++2H2O?Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解;
(2)工业上常利用硝酸铜溶液电镀铜,电镀时,镀层金属做阳极,待镀物质做阴极,阴极的电极反应式是:Cu2++2e-=Cu
故答案为:Cu2++2e-=Cu;
(3)a.处于曲线上的点为饱和溶液状态,A点在曲线上方,应为过饱和溶液,故a错误;
b.B点为生成晶体的转折点,两种晶体可以共存,故b正确;
c.上述流程是在低温下进行的.最终得到的晶体是Cu(NO3)2?6H2O,故c错误;
d.由图象可以看出,溶液降温至30℃以下,可以析出Cu(NO3)2?6H2O晶体,故d正确,
故答案为:b、d;
(4)液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是;N2O4?NO++NO3-;Cu与液态N2O4反应制得无水硝酸铜,根据质量守恒和电子守恒可写出反应的化学方程式为Cu+2N2O4=Cu(NO3)2+2NO↑,
故答案为:N2O4?NO++NO3-;Cu+2N2O4=Cu(NO3)2+2NO↑;
本题解析:
本题难度:一般
2、填空题 下图为铜片与浓硝酸的反应装置示意图,据图回答下列问题
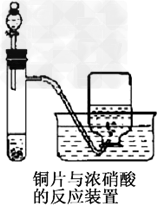
(1)写出试管内发生反应的化学方程式________________________
(2)描述在实验过程中观察到的试管内液体呈________色;试管内液体上方气体呈
________色;集气瓶内收集到的气体呈________色。
(3)在反应一段时间后,从分液漏斗处向试管内加入蒸馏水,请描述加水后试管内和集气瓶内颜色的变化情况:试管内液体呈________色;试管内液体上方气体呈________色。
参考答案:(1)Cu+4HNO3==Cu(NO3)2+2NO2↑+2H2O?
(2)绿;红棕;无?
(3)蓝;无(或红棕色变浅)
本题解析:
本题难度:一般
3、选择题 一定质量的铜和足量的浓硝酸或稀硝酸完全反应,在相同条件下用排水集气法收集产生的气体。下列叙述正确的是
[? ]
①硝酸浓度越大,消耗的硝酸越少 ②硝酸浓度不同,生成的Cu(NO3)2的物质的量相同 ③硝酸浓度越大,产生的气体越少 ④用排水法收集到的气体在相同状况下体积相同
A.①③
B.②④
C.③④
D.①②③
参考答案:C
本题解析:
本题难度:简单
4、填空题 氧化还原反应在工农业生产和日常生活中有广泛运用
(1)人通过呼吸作用吸入氧气,氧化体内的葡萄糖(C6H12O6)提供能量以维持生命活动,反应为:
C6H12O6+6O2→6CO2+6H2O+能量,该反应中的还原剂是______________。
(2)罐头厂在装食物罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类食物防腐剂应具有____________。(填“氧化性”或“还原性”)
(3)铁是生物体中不可缺少的微量元素,铁在人体中是以Fe2+和Fe3+的形式存在的,而 Fe2+更容易被吸收。服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中维生素C所起的作用是_________。(填“氧化作用”或“还原作用”)
(4)缺铁性贫血患者应补充Fe2+,通常以硫酸亚铁的形式,而硫酸铁则无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是_____________。
(5)Fe3+在工业上有重要用途。例如印刷电路板是由高分子材料和铜箔复合而成,可用FeCl3溶液作“腐蚀剂”刻制印刷电路,生成CuCl2和FeCl2,写出离子方程式____________________。
参考答案:(1)C6H12O6
(2)还原性
(3)还原作用
(4)保护FeSO4不被空气中的氧气氧化
(5)2Fe3++Cu==2Fe2++Cu2+
本题解析:
本题难度:一般
5、选择题 一定条件下,下列各组物质混合后,两种反应物最有可能恰好反应完的是
[? ]
A.盐酸与MnO2共热制Cl2
B.铜片、浓硫酸
C.大理石块、硫酸
D.银与硝酸
参考答案:D
本题解析:
本题难度:一般