微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 为了测定石灰石的纯度,有下列实验装置可供选择。已知石灰石中所含杂质不与盐酸反应,从装置A中导出的气体混有少量的氯化氢气体和水蒸气,试回答下列有关问题:
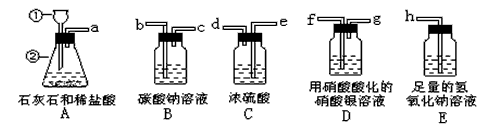
?(1)写出装置A中有下列标号的仪器名称:①是________②________
(2)写出装置A中发生的化学反应式________________
(3)实验时有关装置导管口的连接顺序为a接_____,▁▁▁▁接▁▁▁▁,▁▁▁▁接▁▁▁▁
2、简答题 某同学拟定了以下实验方案,来确定一批合金废料的成分并加以回收利用.
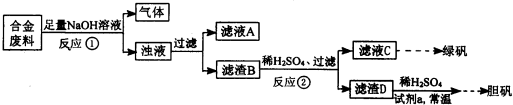
请回答下列问题:
(1)从上述信息可确定该合金中一定含有Fe和______(填化学式).
(2)“试剂a”是一种不引入杂质的绿色氧化剂,该氧化剂的化学式为______;滤渣D、稀硫酸和试剂a总反应的化学方程式为______.
(3)若反应①产生的气体是H2,则验证滤液A只含NaAlO2、不含Na2SiO3的方法是:取少量滤液A于试管中,滴加______.
Na2SiO3溶液与过量的CO2反应的离子方程式为______.
(4)取质量均为13.2g的滤渣B四份,分别加入相同浓度,不同体积的稀HNO3充分反应,标准状况下所生成的NO(设还原产物只有一种)体积与剩余固体金属的质量如下表:
| 实验编号 | ① | ② | ③ | ④
稀HNO3体积(mL)
100
200
300
400
剩余金属质量(g)
9.0
4.8
0
0
NO体积(L,体积)
1.12
2.24
3.36
4.48
|
①实验①最先溶解的金属发生反应的化学方程式是______.
②滤渣B中Fe的质量分数为______%(精确到0.1%).
3、实验题 为分析当地的空气质量状况,某校化学研究性学习小组的同学拟测定城市上空空气中SO2的含量并制定了下列研究方案:
I.相关文献调研:了解空气中主要污染指标,其中SO2对人体有哪些危害;了解SO2的化学性质,为测定
SO2的含量寻找理论依据。资料表明,SO2具有较强的还原性,能与酸性KMnO4溶液(紫色,其还原产物Mn2+在水溶液中接近无色)发生如下反应:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+
Ⅱ.设计实验方案:
方案一:利用SO2能使品红溶液褪色的原理进行半定量分析;
方案二;利用SO2的还原性进行定量分析。
Ⅲ.选择分析地点:某工业区、某公园、某居民小区、某商业区、某交通枢纽。
Ⅳ,选择分析时间:晴天、风速较小时;晴天、风速较大时;雨前;雨后。
Ⅴ.对测定的结果进行初步分析并向相关单位提出建议。
请你参与该研究性学习小组的活动并发表你的见解:
(1)如果利用方案一的半定量分析空气中SO2的含量,你建议配制的品红溶液的浓度____________(填“宜大不宜小”、“宜小不宜大”或“大小均可”)。
(2)该小组的同学拟用下列装置通过方案二定量分析空气中SO2的含量

|
①装置中棉花的作用是_________ 通入空气前应进行的实验操作是______________;
②你建议看到______现象时,停止通空气。
(3)下图是该小组同学根据实验测得的县城不同地区空气中SO2含量
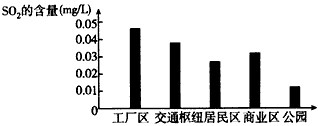
①工厂区、交通枢纽SO2含量明显高于其他地区的原因是_____________
②请你向当地有关部门提出一条减少工厂区SO2排放的建议______________。
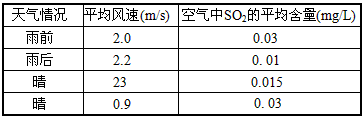
(4)下表是该小组同学测得的不同天气情况下的当地空气中SO2的平均含量。请你分析雨后或风速较大时
SO2平均含量较低的原因__________________
4、简答题 根据环保要求,在处理有氰电镀废水时,剧毒的CN-在催化剂TiO2颗粒作用下,先用NaClO将CN-氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2.环保工作人员在密闭系统中用下图装置进行实验,测定CN-被处理的百分率.
现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.2mol/L)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.该实验是通过测定CO2的量来确定对CN-的处理效果.回答下列问题:
(1)根据题意写出乙中反应的离子方程式______
(2)丙装置中的试剂是______(填名称);丁装置的目的是______.干燥管Ⅱ的作用是______.
(3)假定上述每一个装置都充分吸收,则利用该装置计算得出的CN-被处理的百分率与实际值相比______(填:“偏高”或“偏低”),简述可能的原因:______.
(4)若干燥管Ⅰ中碱石灰增重1.408g,则该实验中计算得出CN-被处理的百分率为______.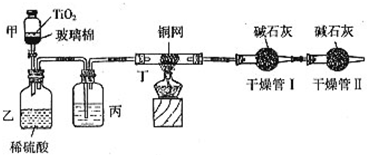
5、选择题 下列实验装置(部分仪器已省略),能达到实验目的是( )
A.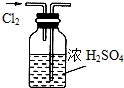
干燥Cl2
B.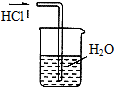
吸收HCl
C.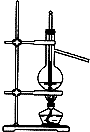
蒸馏石油
D.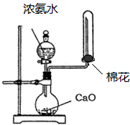 制取氨气
制取氨气