微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 为了测定石灰石的纯度,有下列实验装置可供选择。已知石灰石中所含杂质不与盐酸反应,从装置A中导出的气体混有少量的氯化氢气体和水蒸气,试回答下列有关问题:
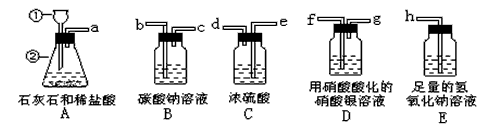
?(1)写出装置A中有下列标号的仪器名称:①是________②________
(2)写出装置A中发生的化学反应式________________
(3)实验时有关装置导管口的连接顺序为a接_____,▁▁▁▁接▁▁▁▁,▁▁▁▁接▁▁▁▁
参考答案:“略”
本题解析:
本题难度:一般
2、简答题 某同学拟定了以下实验方案,来确定一批合金废料的成分并加以回收利用.
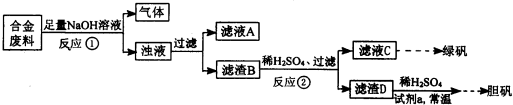
请回答下列问题:
(1)从上述信息可确定该合金中一定含有Fe和______(填化学式).
(2)“试剂a”是一种不引入杂质的绿色氧化剂,该氧化剂的化学式为______;滤渣D、稀硫酸和试剂a总反应的化学方程式为______.
(3)若反应①产生的气体是H2,则验证滤液A只含NaAlO2、不含Na2SiO3的方法是:取少量滤液A于试管中,滴加______.
Na2SiO3溶液与过量的CO2反应的离子方程式为______.
(4)取质量均为13.2g的滤渣B四份,分别加入相同浓度,不同体积的稀HNO3充分反应,标准状况下所生成的NO(设还原产物只有一种)体积与剩余固体金属的质量如下表:
| 实验编号 | ① | ② | ③ | ④
稀HNO3体积(mL)
100
200
300
400
剩余金属质量(g)
9.0
4.8
0
0
NO体积(L,体积)
1.12
2.24
3.36
4.48
|
①实验①最先溶解的金属发生反应的化学方程式是______.
②滤渣B中Fe的质量分数为______%(精确到0.1%).
参考答案:(1)结合产物判断流程中生成蓝矾,说明B中含有铜,①由①、②两组数据分析,两次剩余物的质量相差4.2g,此时生成1.12LNO气体(转移0.075 mol电子).若只溶解铁,质量为4.2g,若只溶解铜,质量为4.8g.由此可知这9g中含有金属Cu,故答案为:Cu;
(2)双氧水是一种绿色氧化剂,在双氧水的作用下,金属铜可以和硫酸发生反应:Cu+H2O2+H2SO4+3H2O=CuSO4?5H2O或Cu+H2O2+H2SO4=CuSO4+2H2O,故答案为:Cu+H2O2+H2SO4+3H2O=CuSO4?5H2O或Cu+H2O2+H2SO4=CuSO4+2H2O;
(3)若反应①产生的气体是H2,则验证滤液A只含NaAlO2、不含Na2SiO3的方法是利用氢氧化铝溶液强酸,硅酸不溶于强酸生成沉淀设计验证,方法为:取少量滤液A于试管中,滴加盐酸,开始生成白色沉淀为氢氧化铝,继续滴加盐酸,氢氧化铝会溶解生成氯化铝,无白色沉淀现象证明不含硅酸钠;过量二氧化碳通入硅酸钠溶液中,碳酸酸性大于硅酸,反应生成硅酸沉淀和碳酸氢钠,反应的离子方程式为:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-;
故答案为:过量盐酸,先有白色沉淀生成,继续滴加盐酸,白色沉淀全部溶解证明不不含硅酸钠;SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-;
(4)①由①、②两组数据分析,两次剩余物的质量相差4.2g,此时生成1.12LNO气体(转移0.075 mol电子).若只溶解铁,质量为4.2g,若只溶解铜,质量为4.8g.由此可知这9g中是金属Cu,铁的还原性大于铜,所以铁先反应,实验①中发生反应的化学方程式为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,故答案为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O;
②实验①有铜存在Fe3+会被还原为Fe2+,在金属消耗完毕以后,硝酸将亚铁离子氧化为三价铁,在亚铁离子转化为铁离子过程中,结合试验①可知还会产生4.48L-3.36L=1.12L的气体NO,物质的量为0.05mol,发生反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;可知反应的Fe2+物质的量为0.15mol,根据铁元素守恒,铁的质量分数=0.15mol×56g/mol13.2g×100%=63.6%;
故答案为:63.6%;
本题解析:
本题难度:简单
3、实验题 为分析当地的空气质量状况,某校化学研究性学习小组的同学拟测定城市上空空气中SO2的含量并制定了下列研究方案:
I.相关文献调研:了解空气中主要污染指标,其中SO2对人体有哪些危害;了解SO2的化学性质,为测定
SO2的含量寻找理论依据。资料表明,SO2具有较强的还原性,能与酸性KMnO4溶液(紫色,其还原产物Mn2+在水溶液中接近无色)发生如下反应:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+
Ⅱ.设计实验方案:
方案一:利用SO2能使品红溶液褪色的原理进行半定量分析;
方案二;利用SO2的还原性进行定量分析。
Ⅲ.选择分析地点:某工业区、某公园、某居民小区、某商业区、某交通枢纽。
Ⅳ,选择分析时间:晴天、风速较小时;晴天、风速较大时;雨前;雨后。
Ⅴ.对测定的结果进行初步分析并向相关单位提出建议。
请你参与该研究性学习小组的活动并发表你的见解:
(1)如果利用方案一的半定量分析空气中SO2的含量,你建议配制的品红溶液的浓度____________(填“宜大不宜小”、“宜小不宜大”或“大小均可”)。
(2)该小组的同学拟用下列装置通过方案二定量分析空气中SO2的含量

|
①装置中棉花的作用是_________ 通入空气前应进行的实验操作是______________;
②你建议看到______现象时,停止通空气。
(3)下图是该小组同学根据实验测得的县城不同地区空气中SO2含量
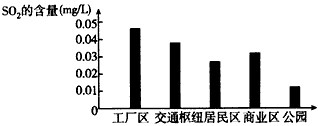
①工厂区、交通枢纽SO2含量明显高于其他地区的原因是_____________
②请你向当地有关部门提出一条减少工厂区SO2排放的建议______________。
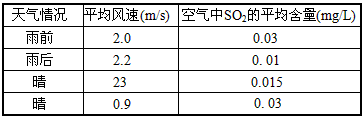
(4)下表是该小组同学测得的不同天气情况下的当地空气中SO2的平均含量。请你分析雨后或风速较大时
SO2平均含量较低的原因__________________
参考答案:(1)宜小不宜大
(2)①防止固体颗粒进入KMnO4溶液中;检查装置的气密性;②KMnO4溶液刚好褪色
(3)①工厂尾气、汽车尾气中SO2含量较高;②提高脱硫技术(或改用更洁净的能源或提高尾气的处理技术或对尾气进行综合利用等合理答案均可)
(4)原因可能是下雨时SO2和水反应降低了雨后空气中SO2的含量;风速越大,气体扩散速度越大,空气中SO2浓度越小
本题解析:
本题难度:一般
4、简答题 根据环保要求,在处理有氰电镀废水时,剧毒的CN-在催化剂TiO2颗粒作用下,先用NaClO将CN-氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2.环保工作人员在密闭系统中用下图装置进行实验,测定CN-被处理的百分率.
现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.2mol/L)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.该实验是通过测定CO2的量来确定对CN-的处理效果.回答下列问题:
(1)根据题意写出乙中反应的离子方程式______
(2)丙装置中的试剂是______(填名称);丁装置的目的是______.干燥管Ⅱ的作用是______.
(3)假定上述每一个装置都充分吸收,则利用该装置计算得出的CN-被处理的百分率与实际值相比______(填:“偏高”或“偏低”),简述可能的原因:______.
(4)若干燥管Ⅰ中碱石灰增重1.408g,则该实验中计算得出CN-被处理的百分率为______.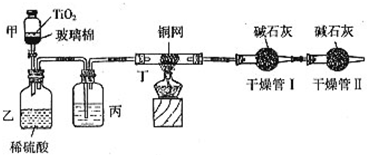
参考答案:(1)根据题意可知,甲中的反应为NaClO将CN-离子氧化成CNO-,NaClO具有强氧化性,被还原为Cl-,反应离子方程式为CN-+ClO-═CNO-+Cl-;乙中的反应为酸性条件下CNO-与NaClO反应生成N2、CO2和Cl2,反应离子方程式为2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O,
故答案为:2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O;
(2)实验原理为测量干燥管Ⅰ吸收的二氧化碳的质量确定对CN-的处理,由于乙装置中产生N2、CO2、Cl2、H2O,氯气与水都能被碱石灰吸收,影响二氧化碳质量的测定.所以进入干燥管Ⅰ的气体应除去氯气与水,用浓硫酸吸水,用铜网除去氯气.同时应防止空气中的CO2、水蒸气进入干燥管Ⅰ干扰实验.故丙装置中的试剂是浓硫酸;丁装置的目的是除去Cl2;干燥管Ⅰ的作用是吸收CO2,干燥管Ⅱ的作用是防止空气中的CO2、水蒸气进入干扰实验,
故答案为:浓硫酸;除去Cl2;防止空气中的CO2、水蒸气进入干燥管Ⅰ,干扰实验;
(3)装置中残留有CO2未被完全吸收,导致测定的二氧化碳质量偏低,测得的CN-被处理的百分率与实际值相比偏低,
故答案为:偏低;装置中残留有CO2未被完全吸收;
(4)干燥管Ⅰ中碱石灰增重1.408g为二氧化碳的质量,物质的量为1.408g44g/mol=0.032mol,根据碳元素守恒可知被处理的CN-的物质的量为n(CN-)=n(CO2)=0.032mol,原溶液中CN-的物质的量为0.2L×0.2mol/L=0.04mol,所以该实验中测得CN-被处理的百分率为0.032mol0.04mol×100%=80%,
故答案为:80%.
本题解析:
本题难度:一般
5、选择题 下列实验装置(部分仪器已省略),能达到实验目的是( )
A.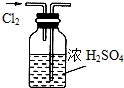
干燥Cl2
B.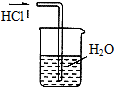
吸收HCl
C.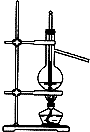
蒸馏石油
D.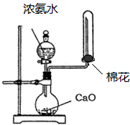 制取氨气
制取氨气
参考答案:D
本题解析:
本题难度:简单