微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组物质中都是由分子构成的化合物是
A.CO2、NO2、SiO2
B.HCl、NH3、CH4
C.NO、CO、CaO
D.O2、N2、Cl2
参考答案:B
本题解析:
本题难度:简单
2、选择题 在标准状况下,取甲、乙、丙各100mL相同浓度的盐酸,分别加入组成相同的镁铝合金粉末,得到的气体体积(标准状况)与合金的质量有关数据如下表;
A.甲组中盐酸过量,丙组中金属过量
B.盐酸的物质的量浓度为1mol/L
C.合金中镁,铝的物质的量之比是1:1
D.向甲容器中继续加入350mL1.00mol?L-1NaOH溶液时,生成沉淀0.1mol
参考答案:BD
本题解析:分析:甲中加入2.55g合金时生成气体的体积为2.80L,继续加入合金,最多生成3.36L气体,说明甲中盐酸过量,且生成气体最多为3.36L,根据反应的相关方程式计算.
解答:A.甲中加入2.55g合金时生成气体的体积为2.80L,继续加入合金,最多生成3.36L气体,说明甲中盐酸过量,金属不足,分别加入金属3.85g和4.59g时,生成气体的体积相等,则说明丙组中金属过量,故A正确;
B.不管加多少镁铝合金,最多只能生成3.36L的氢气,说明盐酸最多只能产生3.36L的氢气.所以就3.36L来计算盐酸的物质的量. 气体的物质的量为: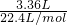 =0.15mol,
=0.15mol,
根据方程式,可计算出HCl的物质的量为0.15mol×2=0.3mol,盐酸的物质的量浓度为: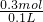 =3mol/L,故B错误;
=3mol/L,故B错误;
C.由于甲组中,盐酸是过量的,所以用甲组来计算,设Mg的物质的量为x,Al的物质的量为y,
生成气体的物质的量为: =0.125mol,
=0.125mol,
依题意得:24x+27y=2.55g;x+ y=0.125mol,
y=0.125mol,
解方程组得:x=0.05;y=0.05,
所以物质的量之比为1:1,
故C正确;
D.当甲中Mg2+、Al3+全部生成沉淀时,溶液的溶质为NaCl,已知n(Cl-)=0.15mol×2=0.3mol,则需1.00mol?L-1NaOH溶液
300ml,此时加入350mL1.00mol?L-1NaOH溶液,则有Al(OH)3+OH-=AlO2-+2H2O,所以沉淀的物质的量小于0.1mol,故D错误;
故选BD.
点评:本题考查混合物的计算,题目难度较大,注意根据表中数据判断合金与盐酸反应的过量问题为解答本题的关键.
本题难度:困难
3、选择题 下列关于钠的说法正确的是
A.钠是活泼的非金属
B.钠与水反应放出氧气
C.钠与水反应放出氢气
D.钠不能保存在易燃品煤油中
参考答案:C
本题解析:钠原子的最外层只有1个电子,是活泼的金属,易和水反应生成氢气和氢氧化钠。钠也极易被氧化,钠的密度大于煤油的,所以可保存在煤油中,因此正确的答案是C。
本题难度:简单
4、选择题 有一瓶Na2SO3溶液,可能部分被氧化.某同学用此溶液进行如下实验:取少量溶液,滴入硝酸钡溶液产生白色沉淀,再加入足量稀HNO3,充分振荡后仍有白色沉淀,对此实验下列结论正确的是
A.Na2SO3已部分氧化
B.加入硝酸钡溶液生成的沉淀一定含BaSO4
C.加入HNO3后的不溶沉淀一定为BaSO3
D.此实验不能确定Na2SO3是否部分氧化
参考答案:D
本题解析:
本题难度:一般
5、选择题 下列关于Fe2+和Fe3+的叙述中,错误的是
A.Fe2+的水溶液为浅绿色
B.Fe2+既有氧化性,又有还原性
C.Fe3+的水溶液为黄色
D.Fe3+溶液中滴入SCN-,立即出现红色沉淀
参考答案:D
本题解析:分析:根据常见离子的颜色判断A、C选项;根据化合价的高低判断氧化性、还原性来确定B选项;根据Fe3+与SCN-反应现象判断D选项,
解答:A:中学常见水溶液有颜色离子有:Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO4-(紫色),故A对.
B:氧化性是指物质得电子的性质,还原性是指物质失电子的性质,元素处于最高价态时,只表现为氧化性,元素处于最低价态时,只表现为还原性,处于中间价态,既表现氧化性,又表现还原性.如:H2O中H为+1价(最高价态),表现为氧化性,O为-2价(最低价态),表现为还原性,所以H2O既有氧化性,又有还原性;Fe2+处于中间价态,既能得电子,又能失电子,所以既有氧化性,又有还原性.故B对.
C:由A知Fe3+的水溶液为黄色,故C对.
D:Fe3+溶液中滴入SCN-,溶液呈红色,不会出现红色沉淀,类似的有Fe(OH)3胶体,呈红褐色.故D错.
故选D
点评:1、中学常见水溶液有颜色离子有:Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO4-(紫色),
2、氧化性、还原性的判断:最高价态的元素只有氧化性,最低价态元素只有还原性,中间价态的既有氧化性又有还原性.
本题难度:简单