微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在a LAl2(SO4)3和(NH4)2SO4的混合溶液中加入b mol的BaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量强碱并加热可得到cmolNH3,则原溶液中的Al3+的浓度(mol/L)为
[? ]
A.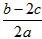
B.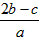
C.
D.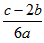
参考答案:C
本题解析:
本题难度:简单
2、选择题 下列气体所含原子数最多的是( )
A.7.5gC2H6
B.14gN2
C.7gCO
D.24gO2
参考答案:A.一个乙烷分子中含有8个原子,7.5g乙烷中原子总数=7.5g30g/mol×8×NA/mol=2NA;
B.一个氮气分子中含有2个原子,14g氮气中原子总数=14g28g/mol×2×NA/mol=NA;
C.一个一氧化碳分子中含有2个原子,7gCO中原子总数=7g28g/mol×2×NA/mol=0.5NA;
D.一个氧气分子中含有2个原子,24g氧气中原子总数=24g32g/mol×2×NA/mol=1.5NA,
通过以上分析知,原子总数最多的是乙烷,
故选:A.
本题解析:
本题难度:一般
3、选择题 由钾和氧组成的某种离子晶体含钾的质量分数是78/126,其阴离子只有过氧离子(O22-)和超氧离子(O2-)两种。在此晶体中,过氧离子和超氧离子的个数之比为
[? ]
A.1:1
B.1:2
C.2:1
D.1:3
参考答案:B
本题解析:
本题难度:一般
4、计算题 (6分)利用“化学计量在实验中的应用”的相关知识进行填空
(1)含有6.02×1023个氧原子的H2SO4的物质的量是_________?
(2)将4 g NaOH溶解在10 mL水中,再稀释成1 L,从中取出10 mL,这10 mL溶液的物质的量浓度为_______。
(3)将50 mL 0.1 mol·L-1 NaCl和50 mL 0.5 mol·L-1 CaCl2溶液混合后,若溶液的体积为二者体积之和,则混合溶液中c (Cl-)为?______________。
参考答案:(每空2分,共6分)(1)0.25mol? (2)0.1mol/L? (3)0.55mol/L
本题解析:(1)根据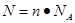 可知,含有6.02×1023个氧原子物质的量是
可知,含有6.02×1023个氧原子物质的量是
6.02×1023÷6.02×1023/mol=1mol。所以根据硫酸的化学式H2SO4可知,硫酸的物质的量是1mol÷4=0.25mol。
(2)根据n=m/M可知,4g氢氧化钠的物质的量是4g÷40g/mol=0.1mol。依据c=n/V可知,该溶液的浓度是0.1mol÷1L=0.1mol/L。由于溶液是均一的,所以取出的10ml溶液其浓度还是0.1mol/L。
(3)混合前氯化钠和氯化钙中氯离子的物质的量分别是0.05L×0.1mol/L=0.005mol、0.05L×0.5mol/L×2=0.05mol。所以混合后氯离子的物质的量是0.005mol+0.05mol=0.055mol。而溶液的体积是100ml,所以混合后氯离子浓度是0.055mol÷0.1L=0.55mol/L。
点评:在进行物质的量的有关计算时,关键是熟练应用几个关系式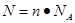 、n=m/M、
、n=m/M、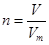 、
、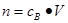 ,特别还要注意气体摩尔体积和阿伏加德罗定律的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。如果是计算溶液中离子浓度,还需要注意溶质的化学式以及对应的电离方程式,才能准确计算某离子浓度。如果是计算离子的物质的量,还需要注意溶液的体积变化。
,特别还要注意气体摩尔体积和阿伏加德罗定律的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。如果是计算溶液中离子浓度,还需要注意溶质的化学式以及对应的电离方程式,才能准确计算某离子浓度。如果是计算离子的物质的量,还需要注意溶液的体积变化。
本题难度:一般
5、计算题 将总量为4molNa2O2和Al2(SO4)3的 混合物投入足量水中,充分反应后生成Ymol沉淀
混合物投入足量水中,充分反应后生成Ymol沉淀
(Y>0),若以x表示原混合物中Na2O2的物质的量。
(1)试建立Y= f(x)的函数关系式,将x的取值Y= f(x)关系式填写在表内(可以不用填满)
(2)作图
参考答案:(10分)
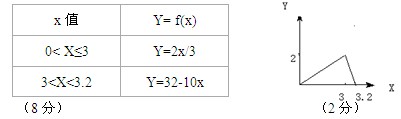
本题解析:略
本题难度:一般