微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b
参考答案:
本题解析:
本题难度:一般
2、填空题 (8分)氯碱工业中电解饱和食盐水的原理示意图如下图所示:

(1)电极a是电源的?。
(2)溶液A的溶质是(填化学式)?。
(3)电解饱和食盐水的离子方程式是?。
(4)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用? _______________________________________________________?。
(5)电解所用的盐水需精制,去除盐水中的Ca2+、Mg2+、NH4+和SO42-,提供的试剂有① Na2CO3溶液② BaCl2 溶液③ NaOH溶液④ HCl,加入试剂的顺序是________________。
参考答案:(1)正极(1分)(2)NaOH (1分)
(3)2Cl-+2H2O 2OH-+H2↑+Cl2↑(2分)
2OH-+H2↑+Cl2↑(2分)
(4)氯气与水反应:Cl2+H2O HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,有利于氯气的溢出。(2分)
HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,有利于氯气的溢出。(2分)
(5)②③①④或③②①④(2分)
本题解析:(1)惰性电极电解饱和食盐水,阳极氯离子放电生成氯气,阴极氢离子放电生成氢气,所以a是正极,b是负极。
(2)阴极氢离子放电,破坏了阴极周围水的电离平衡,所以阴极周围溶液显碱性,产生氢氧化钠。
(3)离子方程式为2Cl-+2H2O 2OH-+H2↑+Cl2↑。
2OH-+H2↑+Cl2↑。
(4)由于阳极生成氯气,而氯气与水反应:Cl2+H2O HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,有利于氯气的溢出。
HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,有利于氯气的溢出。
(5)Ca2+用CO32-,Mg2+、NH4+用OH-,SO42-用Ba2+,过量的Ba2+需要用CO32-,所以正确的顺序是②③①④或③②①④。
本题难度:一般
3、填空题 某课外活动小组同学用下图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题。
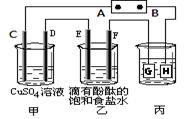
(1)A为电源的?极;
(2)E的电极反应式为:?;
(3)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为?;
(4)在常温下,现用丙装置给铁镀铜,则H电极材料应该是?,
当丙中铁表面析出铜的3.2g时,乙中溶液的PH值为?(假设溶液体积为1L);
(5)在电解一段时间后在甲中加入适量?可以使溶液恢复到原来的浓度。
参考答案:(1)负极?(2)? 2H+2e-=H2↑?(3)? 2:1:2:2?(4)?铜? 13?
(5)CuO(若考虑到水开始电解Cu(OH)2也可以)
本题解析:考查电化学的应用。
(1)C电极表面有铜析出,说明C是阴极,所以A是电源的负极,B是正极H、F、D都是阳极,G和E是阴极。
(2)E是阴极,根据离子的放电顺序可知,溶液中的氢离子放电,反应式为2H+2e-=H2↑。
(3)根据离子的放电能量可判断,C、D、E、F电极产生的单质铜、氧气、氢气和氯气。根据电子的得失守恒可知,四种单质的物质的量之比是2:1:2:2。
(4)电镀时镀层金属作阳极,待镀金属作阴极,含有镀层金属离子的溶液作电镀液,H是阳极,所以电极材料是铜。3.2g铜转移电子是 ,所以乙中生成的氢氧化钠是0.1mol,浓度是0.1mol/L,则pH=13。
,所以乙中生成的氢氧化钠是0.1mol,浓度是0.1mol/L,则pH=13。
(5)甲中的电解产物是铜、氧气和硫酸,所以要使溶液恢复到原来的浓度,应该加入氧化铜。
本题难度:一般
4、选择题 下列描述中,不符合生产实际的是( )
A.合成氨工业中,N2和H2的最佳配比应为物质的量之比1:3
B.电解法精炼粗铜,用纯铜作阴极
C.工业上电解饱和食盐水制烧碱,用离子交换膜阻止0H-移向阳极
D.在镀件上电镀锌,锌作阳极
参考答案:A、合成氨工业中,氮气比较廉价,为了提高氢气的转化率要加入过量的氮气,所以N2和H2的物质的量之比大于1:3,故A错误.
B、电镀时,镀层作阳极,镀件作阴极,所以纯铜作阴极,粗铜作阳极,故B正确.
C、工业上电解饱和食盐水制烧碱,溶液中阴离子向阳极移动,阳离子向阴极移动,用离子交换膜阻止0H-移向阳极,故C正确.
D、电镀时,镀层作阳极,镀件作阴极,镀层为锌,所以锌作阳极,故D正确.
故选A.
本题解析:
本题难度:简单
5、选择题 如图a、b、c、d均为铂电极,供选择的电解质溶液如下表:
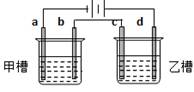
要满足的条件是:①工作一段时间后,甲槽电解液pH上升,而乙槽电解液pH下降;
②b、c两极放电离子的物质的量相等。则应选用的电解液是
组
| A
| B
| C
| D
|
甲槽
| NaOH
| Cu(N O3)2
| KCl
| Na2SO4
|
乙槽
| CuSO4
| NaCl
| AgNO3
| NaNO3
参考答案:C
本题解析:观察四选项可知,依据电解反应及离子的放电顺序:满足甲槽中电解液pH上升的只有AC选项符合,排除BD;而AC选项中乙槽电解液pH均下降符合题意。
A选项中的b电极反应式分别为:4OH--4e-=2H2O+O2↑? c电极反应:Cu2++2e-=Cu
C选项中的b电极反应式分别为:2Cl--2e-=Cl2↑? c电极反应:Ag++e-=Ag
依题目要求,在等量的电子通过的情况下,b、c两极放电离子的物质的量相等,排除A项
故答案为C
本题难度:简单
|