微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 若NA表示阿佛加德罗常数,下列说法正确的是
A.1 mol Cl2作为氧化剂得到的电子数为NA
B.14 g氮气中含有7NA个电子
C. 1L 0.1mol/L蔗糖溶液中所含分子数为0.1NA
1mol CH3+(碳正离子)中含有的电子数为10 NA
参考答案:B
本题解析:A 错误,与铁反应得到的电子数为2NA
B 正确
C 错误,蔗糖溶液中还含有水分子
D 错误,1mol CH3+(碳正离子)中含有的电子数为9 NA
本题难度:一般
2、选择题 下列说法正确的是
A.0.5mol SO2和11.2LCO2所含的分子数目一定相等
B.25℃和100℃时,水的pH相等
C.中和等体积、等物质的量浓度的NaOH和氨水所消耗的n(H2SO4)相等
D.2SO2(g)+O2(g) 2SO3(g) 和4SO2(g)+2O2(g)
2SO3(g) 和4SO2(g)+2O2(g)  4SO3(g)的△H相等
4SO3(g)的△H相等
参考答案:C
本题解析:A、未标明状态,故无法确定;B、沸水pH在6左右,冰水的大于7,25℃等于7;C、正确。D选项,后者为前者的二倍。
本题难度:一般
3、选择题 在高温下,用CO还原m g氧化铁得n g铁,已知氧的相对原子质量为16,则铁的相对原子质量为(?)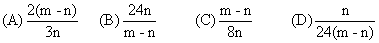
参考答案:B
本题解析:铁的相对原子质量为M,则根据铁原子守恒可知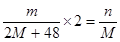 ,解得M=
,解得M=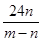 ,答案选B。
,答案选B。
本题难度:一般
4、选择题 有Na2CO3、NaHCO3、CaO和NaOH组成的混合物28.2g,把它们溶于足量的水,充分反应后,溶液中Ca2+、CO32—、HCO3—均转化为沉淀,将容器中的水分蒸干,最后得到白色固体物质共30g。则下列有关叙述错误的是
A.原混合物中含Na2CO3 0.1 mol
B.原混合物中n(Na2CO3)+n(NaHCO3)=n(CaO)
C.30g固体中一定存在n(CaCO3)<n(NaOH)
D.不能确定原混合物中NaOH的质量
参考答案:
本题解析:由于溶液中Ca2+、CO32-、HCO3-全部转化为沉淀,所以,后得到白色固体30g应为碳酸钙和氢氧化钠的混合物。可看作发生了以下反应:Na2CO3+CaO + H2O=CaCO3 +2NaOH;NaHCO3+CaO+H2O=CaCO3 +NaOH + H2O,由此可以看出:固体质量的变化仅由反应Na2CO3+CaO + H2O=CaCO3 +2NaOH造成。
Na2CO3+CaO + H2O=CaCO3 +2NaOH
106? 18
x? 30.0g-28.2g=1.8g
x=10.6g,故Na2CO3的物质的量为0.1mol,A正确;Na2CO3与CaO按1:1反应,NaHCO3与CaO按1:1反应,故n(Na2CO3)+n(NaHCO3)=n(CaO),B正确;由于NaOH在反应物中存在,反应后又生成一部分NaOH,故NaOH的量不可求,故C错误,D正确。
本题难度:一般
5、填空题 某同学用NaOH固体配制250mL?2mol/L的NaOH溶液,并进行有关实验.请回答下列问题:
(1)需要称取NaOH固体______g.
(2)配制该NaOH溶液时使用的仪器除托盘天平(砝码、镊子)、药匙、量筒、250mL容量瓶、胶头滴管外,还必须用到的仪器有______、______等.
(3)取所配制的NaOH溶液100mL,与一定质量的铝充分反应,铝全部溶解后,生成的气体在标准状况下的体积为3.36L,则参加反应的铝的质量为______g.
参考答案:(1)根据稀释定律,稀释前后溶质的物质的量不变,来计算NaOH固体的质量,设NaOH固体的质量为xg,则xg40g/mol=0.25L×2mol/L,解得:x=20,
所以应称取NaOH固体的质量是20g,故答案为:20;
(2)操作步骤有计算、称量、稀释、移液、洗涤移液、定容、摇匀等操作,用托盘天平称取氢氧化钠,在烧杯中稀释,用玻璃棒搅拌,冷却至室温后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切,盖好瓶塞颠倒摇匀.
所以需要的仪器为:玻璃棒、烧杯、胶头滴管、托盘天平、250mL容量瓶,
故答案为:玻璃棒;烧杯;
(3)设参加反应的铝的质量为x,则
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
54?22.4L×3
x?3.36L
所以54x=22.4L×33.36L?
解得? x=2.7g.
故答案为:2.7.
本题解析:
本题难度:一般