微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 下表为部分短周期元素性质的数据:
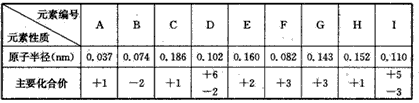
(1)写出下列元素的元素符号:C________ ,D _______,I____。
(2)A与B按原子个数比2:1组成一种化合物甲,B与C按原子个数比1:1组成一种化合物乙,甲与乙发生反应的化学方程式为____。
(3)E和G的单质常用于制造合金,某同学为测定某种E、G合金中E单质的含量,在标准状况下进行甲、乙、丙三组实验: 三组各取30.0mL同浓度的盐酸,加入该合金样品粉末,产生气体,有关数据如下表所示:则该合金中E单质的质量分数为__________________ 。?

参考答案:(1)Na;S;P
(2)2H2O+2Na2O2==4NaOH+O2↑
(3)47.1%
本题解析:
本题难度:一般
2、选择题 钠与水反应的现象与钠的下列性质无关的是(?)
A.钠的熔点低
B.钠的密度小
C.钠的硬度小
D.钠有强的还原性
参考答案:C
本题解析:钠的密度小,浮在水面上。钠的熔点低,钠可以熔化成小球。钠的金属性很强,和水反应剧烈,钠四处游动,所以和钠的硬度无关,答案选C。
点评:钠和水反应是金属钠最重要的化学性质,需要熟练掌握。不但记住实验现象,还要会解释产生现象的原因。该题属于基础性试题,难度不大。
本题难度:一般
3、计算题 (12分)取50.0mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51g白色沉淀,用过量稀硝酸处理后沉淀量减少到4.66g,并有气体放出。
(1)写出混合溶液中加入过量BaCl2后反应的化学方程式(4分)
?,? ?
?
(2)求原混合液中Na2SO4的物质的量浓度;(4分)
(3)产生的气体在标准状况下的体积。(4分)
参考答案:


本题解析:略
本题难度:简单
4、实验题 (11分)已知NaHCO3低温时溶解度小,侯德榜制碱的方法是:向氨化的饱和食盐水中通入过量的二氧化碳,即有晶体析出,经过滤、洗涤、焙烧得纯碱。此过程可以表示为:
① NaCl (饱和) + NH3+CO2+H2O=NaHCO3↓+NH4Cl(此反应是放热反应)
② 2NaHCO3 Na2CO3 +CO2↑+H2O
Na2CO3 +CO2↑+H2O
现某化学小组根据上述原理在实验室中模拟制碱过程,下图C装置是溶有氨和NaCl的溶液,且二者均达到了饱和。
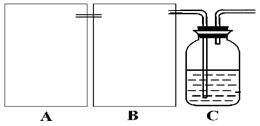
(1)制CO2时为了使反应随开随用,随关随停,上图A方框内应选用以下?装置(填序号)。简述该装置能随关随停的理由?。
(2)为使实验能够进行,在B方框内内应选用上图中的?装置(填写序号),该装置内应装入的试剂是?。
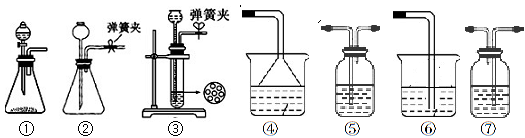
(3)该小组同学按正确的方法连接装置,检验气密性合格后进行实验,发现析出的晶体非常少,在老师的指导下,他们对某个装置进行了改进,达到了实验目的。你认为他们的改进方法是?。
(4)若所用饱和食盐水中含有NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.46g,假设第二步分解时没有损失,则Na2CO3的产率为?(产率为实际产量占理论产量的百分比)。
参考答案:(1)③(1分),关闭弹簧夹后反应生成的气体使上部压强增大,到达一定程度后可把反应液压回漏斗,使固液分离从而停止反应?(2分)
(2)⑤(1分)?饱和碳酸氢钠溶液?(1分)?
(3)将C装置浸泡在一个盛有冰水混合物的水槽里(或大烧杯中)(2分)
(4)65%(2分)
本题解析:(1)①能控制反应的发生但反应的停止不理想,②不能控制反应的发生和停止。只有③通过止水夹来控制反应的发生于停止。关闭弹簧夹后反应生成的气体使上部压强增大,到达一定程度后可把反应液压回漏斗,使固液分离从而停止反应。
(2)B装置的作用是除去二氧化碳中混有的氯化氢气体,故采用将气体通过装饱和碳酸氢钠溶液的洗气瓶吸收氯化氢。故选择⑤。
(3)为增加晶体的析出,可采取降温使碳酸氢钠的溶解度减小从而更易析出。故改进方法可以为“将C装置浸泡在一个盛有冰水混合物的水槽里(或大烧杯中)”。
(4)根据钠原子守恒2NaCl-------Na2CO3
117?: 106
5.85?:? 5.3
理论可生产Na2CO3为5.3克,
又因为
2NaHCO3 -------Na2CO3?
168g?:? 106g
5.46g?:? 3.45g
实际得到碳酸钠为3.445克
所以Na2CO3的产率为:3.445/5.3=0.65
点评:理解侯氏制碱法的原理,方法,注意产率=实际质量/理论得到的质量。
本题难度:一般
5、计算题 (6分)200℃时,11.6gCO2和水蒸气的混合气体与足量的Na2O2充?分反应后固体质量增加了3.6g(如图所示),其原混合物中CO2和H2O的物质的量比。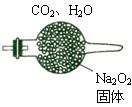
参考答案:1:4
本题解析:设原混合物中CO2和 H2O的物质的量分别为
H2O的物质的量分别为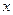 mol、
mol、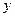 mol
mol
2Na2O22CO2=2Na2CO3+O2?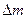
2mol? 56g
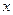 mol? 28
mol? 28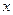 g
g
2Na2O2+2H2O=4NaOH+O2↑?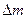
2mol? 4g
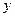 mol? 2
mol? 2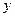 g
g
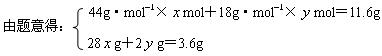
解得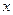 =0.1,
=0.1,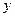 =0.4,故原混合物中CO2和H2O的物质的量比1:4。
=0.4,故原混合物中CO2和H2O的物质的量比1:4。
本题难度:一般