微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 A、B、C、D、E、F均为短周期元素,且原子序数依次递增。A、E同主族,B、D同周期,且B和D最外层电子数之和为10,F的核外电子数为B、C核外电子数之和,A与D可形成A2D、A2D2共价化合物。请回答下列问题:
(1)D位于周期表第 ___周期 ___族。
(2)在E2D2中含有的化学键有_____。
(3)写出E和F两种元素的最高价氧化物对应的水化物反应的离子方程式: __________。
参考答案:
(1)? 二?周期?ⅥA?族?
(2)? 离子键、非极性键(或共价键)?
(3)?Al(OH)3+OH- = AlO2-+2H2O?
本题解析:
本题难度:一般
2、简答题 某同学探究同周期主族元素性质递变规律时,设计了如下实验方案,请完成表中相关内容.
| 实验内容 | 实验现象 | 离子方程式
1:将镁条用砂纸打磨后,放入沸水中,再向水中滴加酚酞试液
______
----
2:将一小块金属钠放入滴有酚酞试液的冷水中
浮在水面上,熔成小球,不定向运动,随之消失,溶液变成红色.
______
3:将镁条投入稀盐酸中
______
Mg+2H+=Mg2++H2↑
4:将铝条投入稀盐酸中
反应不十分剧烈,产生无色气体
______
|
该同学获得的实验结论为______.
参考答案:(1)镁是活泼金属,能与沸水反应生成无色气体H2和Mg(OH)2,Mg(OH)2是中强碱,所以能使酚酞试液变红,故答案为:溶液变浅红,有气泡产生;
(2)金属钠冷水中方程式为2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(3)镁的金属性较强与盐酸反应剧烈,同时生成氢气,故答案为:反应剧烈,产生无色气体;
(4)将铝条投入稀盐酸中,其反应方程为2Al+6H+=2Al3++3H2↑,故答案为:2Al+6H+=2Al3++3H2↑.
从4组实验可知从Na到Al,金属的活泼性逐渐减弱,故同周期,从左到右元素原子失电子能力逐渐减弱;故答案为同周期,从左到右元素原子失电子能力逐渐减弱.
本题解析:
本题难度:一般
3、选择题 下列有关化学用语表示正确的是( )
A.乙烯的结构简式:CH2CH2
B.乙炔的键线式:≡
C.用于文物年代测定的原子:

D.NH3?的电子式
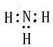
参考答案:A、乙烯的结构简式:CH2=CH2,故A错误;
B、乙炔的键线式为≡,故B正确;
C、用于文物年代测定的原子为146C,故C错误;
D、NH3 的电子式为:

,故D错误;
故选B.
本题解析:
本题难度:简单
4、选择题 下列各组物质的性质比较中,不正确的是:
A.金属性强弱:Na >Mg>Al
B.氢化物稳定性:HF > H2O >NH3
C.碱性强弱:KOH>NaOH>LiOH
D.酸性强弱:HIO4 >HBrO4>HClO4
参考答案:D
本题解析:考查元素周期律的应用。同主族自上而下金属性逐渐增强,非金属性逐渐减弱。同周期自左向右金属性逐渐减弱,非金属性逐渐增强。金属性越强,最高价氧化物的水化物的碱性就越强,非金属性越强,最高价氧化物的水化物的酸性就越强,相应氢化物的稳定性就越强,所以选项D是错误的。答案选D。
本题难度:一般
5、选择题 下表为元素周期表前四周期的一部分,下列有关表中各元素的叙述正确的是( )
A.原子半径的大小顺序是①>②>③>④
B.氢化物的沸点:⑤高于④
C.氢化物的稳定性:⑦比⑥强
D.最高价氧化物对应水化物的酸性:②比③强
参考答案:A、同一周期元素的原子半径随着原子序数的增大而减小;同一族,元素的原子半径随着原子序数的增大而增大,所以原子半径的大小顺序是①>③>②>④,故A错误.
B、同一族元素氢化物的沸点随着相对分子质量的增大而增大,但因水、氟化氢、氨气中含有氢键,所以水的沸点大于硫化氢的,氟化氢的沸点大于氯化氢的,氨气的沸点大于磷化氢的;如果该主族为第ⅣA族,氢化物的沸点:⑤高于④;如果该主族属于第ⅤA族或第ⅥA,氢化物的沸点:④高于⑤,故B错误.
C、同一族元素氢化物的稳定性随着元素的原子序数的增大而减小,所以氢化物的稳定性:⑥比强⑦,故C错误.
D、同一主族元素的最高价氧化物对应水化物的酸性随着原子序数的增大而减小,所以最高价氧化物对应水化物的酸性:②比③强,故D正确.
故选D.
本题解析:
本题难度:简单