微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 一块表面已部分被氧化的钠的质量为0.77 g,放入10 g水中后,得到氢气0.02 g。求:
(1)金属钠表面氧化钠的质量;
(2)所得溶液的质量分数;
(3)被氧化前这块钠的质量。
参考答案:(1)0.31 g
(2)11.2%
(3)0.69 g
本题解析:该样品成分为Na、Na2O,由得到H2的量可以求出Na的量,再由样品总量可求出Na2O的量。
(1)2Na+2H2O====2NaOH+H2↑
46? 80? 2
x? y? 0.02 g
解得x="0.46" g y="0.8" g
m(Na2O)="0.77" g-0.46 g="0.31" g
(2)Na2O+H2O====2NaOH
62? 80
0.31 g? z
解得z="0.4" g
(NaOH)=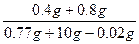 ×100%=11.2%
×100%=11.2%
(3)2Na—Na2O
46? 62
p? 0.31 g
解得p="0.23" g
m(Na)总="0.23" g+0.46 g="0.69" g。
本题难度:简单
2、选择题 下列说法正确的是(?)
A.从Li到Cs,碱金属单质都能跟Cl2反应
B.Na2O2是过氧化物,KO2是超氧化物,它们都不是氧化物
C.碱金属单质都能与氧气反应,反应条件是加热或点燃
D.碱金属单质在空气中燃烧,都能生成过氧化物
参考答案:A
本题解析:O2与Cl2的非金属性相当(常温下Cl2略强于O2),碱金属都能跟O2反应,就都能跟Cl2反应,它们与Cl2反应的产物都是RCl(R代表碱金属),不存在更复杂的碱金属氯化物,这是与氧化物的区别。A选项正确。
氧化物是含有两种元素,且其中一种是氧元素的化合物,由此看来,Na2O2、KO2都是氧化物。B选项不正确。
Rb、Cs遇到氧气能迅速自燃,比白磷还快。C选项不正确。
Li在空气中燃烧产物是Li2O(氧化物)、Na的燃烧产物主要是Na2O2(过氧化物)、K的燃烧产物主要是KO2(超氧化物)。D选项不正确。
本题难度:简单
3、选择题 将0.2 mol? Na投入到足量水中得a g溶液,将0.2 mol Mg投入到足量盐酸中得到b g溶液,则反应后两溶液质量关系为(?)
A.a="b"
B.a>b
C.a<b
D.无法判断
参考答案:A
本题解析:2Na—H2差量为4.6 g-0.2 g="4.4" g,Mg—H2差量为4.8 g-0.4 g="4.4" g。
本题难度:简单
4、选择题 某学生运用所学知识研究钠的性质:将一粒金属钠和一块铜片分别盛在表面皿中,来研究它们在空气中的稳定性。该学生采用的研究方法是:(?)
①假说法 ②实验法?③分类法 ④比较法
A.①②
B.①③
C.②④
D.①③
参考答案:C
本题解析:将一粒金属钠和一块铜片分别盛在表面皿中,通过观察固体表面颜色的变化,来比较二者的稳定性,显然是比较法和实验发,答案选C。
本题难度:简单
5、选择题 在一密封容器中盛有0.8mol Na2O2与1mol NaHCO3,将其加热到3000C,经充分反应后,容器内残留的固体是
A.0.5mol Na2CO3和1mol NaOH
B.1mol Na2CO3和0.6mol NaOH
C.0.8mol Na2CO3和1mol NaOH
D.只有1mol Na2CO3
参考答案:B
本题解析:略
本题难度:一般