微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知化合物A、B、M、N含有同一种元素,且A与B,M与N的元素组成相同,A与B在常温下均呈液态。D为固体单质,与X的浓溶液在常温下作用无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)
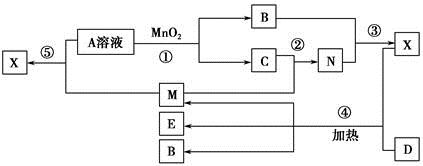
(1)若D与E溶液能够发生化合反应。且溶液在反应前后颜色有变化。
①A的电子式为________。D的化学式为________。
②M与E溶液可发生反应生成X,其离子方程式为________________________
(2)若D为常见的红色金属单质。用情性电极电解100 mL 0.05 moL·L-1E溶液,导线中通过0.08 mol电子,阳极析出的气体体积为________mL(标准状况),假设溶液体积不变,则所得溶液pH=________。
(3)若D为短周期元素形成的黑色固体单质。反应④的化学方程式为___________________________
(4)已知下列几种试剂:
a.无水CuSO4 b.品红溶液 c.酸性KMnO4溶液
d.澄清石灰水 e.饱和NaOH溶液
为了检验(3)中D与X生成的混合气体的成分,某学生用上述试剂(或部分试剂)设计了几种实验方案,下列试剂使用顺序最合理的是________(填序号)。
A.abebd? B.adeb?C.abcbd? D.abd
参考答案:(1)① 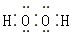 Fe ②2Fe3++SO2+2H2O=2Fe2++
Fe ②2Fe3++SO2+2H2O=2Fe2++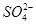 +4H+ (2)448 (3)C+2H2SO4(浓)
+4H+ (2)448 (3)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
(4)C
本题解析:本题以框图推断为载体,主要考查了硫、铁及其化合物的性质,意在考查考生的推断能力及实验能力。(1)A、B均为液体,且组成相同,可能是H2O和H2O2,H2O2在MnO2催化下可分解生成水和O2,故A为H2O2,B为H2O,C为O2;固体单质D与X的浓溶液在常温下不反应,加热时反应生成M、E和H2O,M能与O2反应,D与E溶液能够发生化合反应,且反应前后溶液颜色有变化,则D为Fe,M为SO2,E为Fe2(SO4)3,N为SO3,X为H2SO4。①H2O2中O为-1价,氧原子之间共用一对电子,电子式为 。②SO2具有还原性,Fe3+具有较强的氧化性,SO2在水溶液中可被Fe3+氧化成硫酸。(2)若D为红色单质,则D为Cu,Cu与浓硫酸反应得到的E为CuSO4,用惰性电极电解硫酸铜溶液过程中,阳极生成O2,导线中通过0.08 mol电子时,阳极共生成0.02 mol O2,其体积在标准状况下为448 mL。原溶液中n(CuSO4)=0.1 L×0.05 mol·L-1=0.005 mol,若Cu2+完全反应,转移电子0.005 mol×2=0.01 mol,而实际转移电子为0.08 mol,则说明还存在水的电解,故硫酸铜经电解后完全转化为H2SO4,则c(H+)=2c(CuSO4)=2×0.05 mol·L-1=0.1 mol·L-1,故pH=1。(3)短周期元素中能形成黑色固体单质的是碳,碳与浓硫酸在加热条件下可反应生成CO2、SO2和水。(4)SO2、CO2均是酸性氧化物,与碱反应的现象相似;但SO2具有漂白性和还原性,故可用品红溶液检验SO2,然后用酸性高锰酸钾溶液除去SO2,再用品红溶液检验SO2是否除尽,最后用澄清石灰水检验CO2。由于检验SO2和CO2的试剂均是水溶液,故需首先用无水CuSO4检验产物中的水蒸气,合理的选项为C。
。②SO2具有还原性,Fe3+具有较强的氧化性,SO2在水溶液中可被Fe3+氧化成硫酸。(2)若D为红色单质,则D为Cu,Cu与浓硫酸反应得到的E为CuSO4,用惰性电极电解硫酸铜溶液过程中,阳极生成O2,导线中通过0.08 mol电子时,阳极共生成0.02 mol O2,其体积在标准状况下为448 mL。原溶液中n(CuSO4)=0.1 L×0.05 mol·L-1=0.005 mol,若Cu2+完全反应,转移电子0.005 mol×2=0.01 mol,而实际转移电子为0.08 mol,则说明还存在水的电解,故硫酸铜经电解后完全转化为H2SO4,则c(H+)=2c(CuSO4)=2×0.05 mol·L-1=0.1 mol·L-1,故pH=1。(3)短周期元素中能形成黑色固体单质的是碳,碳与浓硫酸在加热条件下可反应生成CO2、SO2和水。(4)SO2、CO2均是酸性氧化物,与碱反应的现象相似;但SO2具有漂白性和还原性,故可用品红溶液检验SO2,然后用酸性高锰酸钾溶液除去SO2,再用品红溶液检验SO2是否除尽,最后用澄清石灰水检验CO2。由于检验SO2和CO2的试剂均是水溶液,故需首先用无水CuSO4检验产物中的水蒸气,合理的选项为C。
本题难度:困难
2、推断题 下图表示各物质之间的转化关系。已知D、E、Z是中学化学常见单质,其他都是化合物。Z、Y是氯碱工业的产品。D元素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂。E为日常生活中应用最广泛的金属。除反应①外,其他反应均在水溶液中进行。请回答下列问题
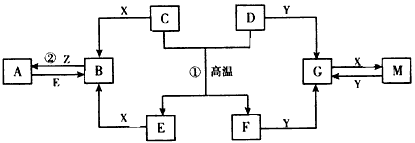
(1)标准状况下,11.2 LH2在Z中完全燃烧生成气态X时,放出Q kJ的热量,请写出相应的热化学反应方程式:_____________________。
(2)G的水溶液显_____(填“酸性”“碱性”或“中性”),其原因是________________ (用离子方程式表示)。
(3)写出反应②的离子方程式:___________________。
(4)写出D与Y的水溶液反应的离子方程式:__________________;若标准状况下有aL气体生成,则该反应转移电子的物质的量为____mol(用含a的代数式表示)。
(5)在电镀工业中,若将E作为待镀金属,锌作为镀层金属,则E是____极,请写出此电极上发生的电极反应式:__________________。
参考答案:
(1)H2(g)+Cl2(g)=2HCl(g) △H=-2Q kJ/mol
(2)碱性;AlO2-+2H2O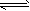 Al(OH)3+OH-
Al(OH)3+OH-
(3)2Fe2++Cl2=2Fe3++2Cl-
(4)2Al+2OH-+2H2O=2AlO2-+3H2↑
(5)阴;Zn2++2e-=Zn
本题解析:
本题难度:一般
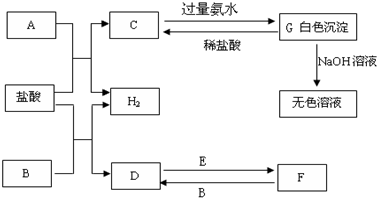
3、简答题 下列物质A~G是我们熟悉的单质或化合物,其中A、B均是常见的金属,E在常温下是黄绿色气体;在适当的条件下,它们之间可以发生如下图所示的转化.
试回答下列问题:
(1)写出E的电子式______
(2)写出C→G的离子方程式______
写出沉淀G与氢氧化钠溶液反应的化学方程式______
(3)写出D→F的离子方程式并用双线桥标出电子转移方向与数目______
(4)检验F中金属阳离子的试剂(写化学式)______.
参考答案:E在常温下是黄绿色气体,E为Cl2,A、B均是常见的金属,G为白色沉淀,能溶于强碱,则G为Al(OH)3,由元素守恒及转化可知,A为Al,C为AlCl3,又由D、F的转化可知,B为变价金属,则B为Fe,D为FeCl2,F为FeCl3,
(1)由上述分析可知,E的电子数为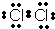 ,故答案为:
,故答案为: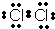 ;
;
(2)C→G的离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,沉淀G与氢氧化钠溶液反应的化学方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;Al(OH)3+OH-=AlO2-+2H2O;
(3)D→F的离子方程式并用双线桥标出电子转移方向与数目为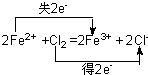 ,
,
故答案为: ;
;
(4)F中金属阳离子为Fe3+,遇KSCN溶液变为血红色,可利用此检验,故答案为:KSCN.
本题解析:
本题难度:一般
4、填空题 (14分)下图中A—J分别代表有关反应中的一种单质或化合物,其中B、C、D、I均为无色气体。(部分产物和反应条件已略去)
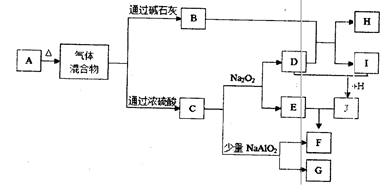
(1)若A加热后得到等物质的量的B和C,则A的化学式为?。
(2)实验室检验B的方法是?。
(3)写出上述由I生成J的化学方程式?。
(4)写出C和少量NaAlO2溶液反应的离子方程式?。
(5)由H所含的两种元素组成的18电子微粒的电子式为?。
(6)若实验室要制备纯净的物质C(可含水蒸气)所需试剂最好选择?(填代号);
A.石灰石?B.稀HNO3?C.稀H2SO4?D.稀HCl? E.纯碱
所需气体发生装置是?(填代号);所选装置中涉及到的玻璃仪器的名称为?。
参考答案:

本题解析:略
本题难度:一般
5、简答题 已知金属单质A是生产生活中用量最大的金属.D是难溶于水的白色固体.F为红褐色固体.无色气体甲遇气体丙立即生成红棕色的气体乙(图中部分产物和反应的条件略).
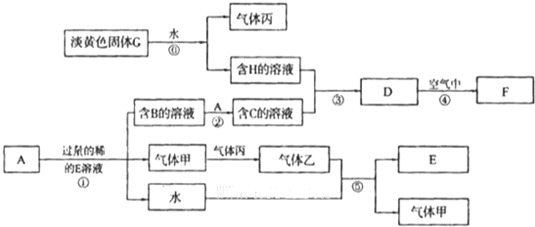
请根据以上信息回答下列问题:
(1)写出下列物质的化学式C______G______.
(2)写出反应①的化学方程式______.反应②的离子方程式______.
(3)反应④整个过程观察到的现象为______.
(4)反应⑤中,若将充满气体乙的试管倒扣在水槽中,充分反应后,试管内液体占试管总体积______.
(5)某种贫血症患者应补充C物质的阳离子.含该离子的药片外表包有一层特殊的糖衣,这层糖衣的作用就是保护该离子不被空气中的氧气氧化.为检验长期放置的药片已经失效,将药片去除糖衣后研碎,取少量研碎的药片放入烧杯中,加适量的蒸馏水,然后滴加数滴______溶液,溶液显______色,表明该药片已失效.
参考答案:A是生产生活中用量最大的金属,D为Fe,F为红褐色固体,则F为Fe2O3,由转化关系可知,反应①为Fe与过量稀硝酸的反应,B为Fe(NO3)3,C为Fe(NO3)2,气体甲为NO,甲遇气体丙立即生成红棕色的气体乙,气体乙为NO2,则丙为氧气,所以淡黄色固体G为Na2O2,H为NaOH,D为Fe(OH)3,
(1)由上述分析可知,C为Fe(NO3)2,G为Na2O2,故答案为:Fe(NO3)2;Na2O2;
(2)反应①的化学方程式为Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,反应②的离子方程式为2Fe3++Fe=3Fe2+,
故答案为:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O;2Fe3++Fe=3Fe2+;
(3)反应④发生氢氧化亚铁被氧化为氢氧化铁的反应,则整个过程观察到的现象为白色沉淀迅速变为灰绿色,最后变为红褐色,
故答案为:白色沉淀迅速变为灰绿色,最后变为红褐色;
(4)反应⑤发生3NO2+H2O=2HNO3+NO,只有NO不溶于水,则充满气体乙的试管倒扣在水槽中,充分反应后,试管内液体占试管总体积的23,故答案为:23;
(5)亚铁离子被氧化生成铁离子,遇KSCN溶液变为血红色,则取少量研碎的药片放入烧杯中,加适量的蒸馏水,然后滴加数滴KSCN(或NH4SCN)溶液,溶液显红色,表明该药片已失效,故答案为:KSCN(或NH4SCN);红.
本题解析:
本题难度:简单