微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 工业上电解饱和食盐能制取多种化工原料,其中部分原料可用于制备多晶硅。
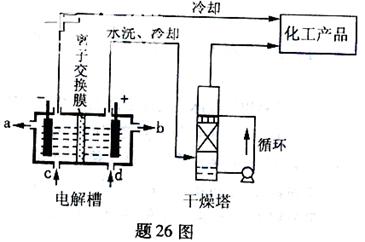
(1)题26图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是?;NaOH溶液的出口为?(填字母);精制饱和食盐水的进口为?(填字母);干燥塔中应使用的液体是?。
(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用收到广泛关注。
①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为?。
②SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:
3 SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)
4SiHCl3(g)
达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为?kg。
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0kg,则生成氢气? (标准状况)。
(标准状况)。
参考答案:(1)①氯气;a;d;浓硫酸(2)①SiCl4+2H2+O2 SiO2+4HCl②0.35(3)134.4
SiO2+4HCl②0.35(3)134.4
本题解析:(1)电解饱和食盐时阳极阴离子Cl—、OH—放电,Cl—的放电能力强于OH—,阳极发生的方程式为:2Cl——2e—===Cl2↑;阴极:2H++2e—===H2↑;总反应为:2NaCl+2H2O Cl2↑+H2↑+2NaOH。H2、2NaOH在阴极,NaOH溶液的出口为a,Cl2在阳极,精制饱和食盐水从阳极进入,选d;要干燥Cl2需要用酸性干燥剂H2SO4或P2O5等,中性干燥剂无水CaCl2。(2)①SiCl4与H2和O2反应,产物有两种,光导纤维的主要成分是SiO2,H、Cl元素必在另一产物中,H、Cl元素结合成HCl,然后配平即可。发生的化学方程式为:SiCl4+2H2+O2
Cl2↑+H2↑+2NaOH。H2、2NaOH在阴极,NaOH溶液的出口为a,Cl2在阳极,精制饱和食盐水从阳极进入,选d;要干燥Cl2需要用酸性干燥剂H2SO4或P2O5等,中性干燥剂无水CaCl2。(2)①SiCl4与H2和O2反应,产物有两种,光导纤维的主要成分是SiO2,H、Cl元素必在另一产物中,H、Cl元素结合成HCl,然后配平即可。发生的化学方程式为:SiCl4+2H2+O2 SiO2+4HCl。②
SiO2+4HCl。②
由3 SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)
4SiHCl3(g)
起始量(mol)? n? 0
变化量(mol)? 3x? 2x? x? 4x
平衡量(mol)? n—2x?4x
4x=0.020mol/L×20L=0.4mol,n—2x=0.140mol/L20L=2.8mol,n=3.0mol,由2NaCl+2H2O Cl2↑+H2↑+2NaOH,(2×58.5)g:1mol=m(NaCl)g:3mol;m(NaCl)=351g=0.351kg。
Cl2↑+H2↑+2NaOH,(2×58.5)g:1mol=m(NaCl)g:3mol;m(NaCl)=351g=0.351kg。
(3)由NaCl转化为NaClO3,失去电子数为6,H2O转化为H2,得到的电子数为2,设产生的H2体积为V,由得失电子守恒有:6×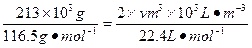 ;V=134.4m3。
;V=134.4m3。
本题难度:一般
2、选择题 下列说法正确的是
A.焰色反应实验后,用稀硫酸洗净铂丝,灼烧至无色,以除去残留在铂丝上的试剂
B.某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,则该溶液一定含有Ag+
C.欲除去氯气中少量氯化氢气体,可将此混合气体通过盛饱和食盐水的洗气瓶
D.托盘天平称取58.50g食盐,加1升水配制成溶液,NaCl溶液浓度为1mol·L-1
参考答案:C
本题解析:A项焰色反应实验后,用稀盐酸洗净铂丝;B项某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,则该溶液不一定含有Ag+,也可能含有SO42-;C正确;D项托盘天平只能称取到0.1g,不能称取58.50g食盐,只能称取58.5g。
点评:属于简单题。
本题难度:一般
3、简答题 某同学用容量瓶配制溶液,加水时不慎超过了刻度线,他把水倒出了一些,重新加水至刻度线,这种做法是否正确,如果不正确,会造成什么后果?该采取什么措置补救?
参考答案:不正确,会导致所配溶液浓度偏低,需倒掉重配
本题解析:加水时不慎超过了刻度线,他把水倒出了一些,重新加水至刻度线,这种做法是不正确的,倒出的溶液中含有一定量的溶质,相当于所配溶液中的溶质减少,而导致溶液的浓度减少;此时应重新配制;
本题难度:简单
4、选择题 化学是以实验为基础的学科,下列有关实验的描述正确的是
A.向两支分别装有碳酸钠和碳酸氢钠固体的试管中各加几滴水,前者温度降低,后者温度升高
B.向100 mL容量瓶中加入4.0 g NaOH固体,然后加水到刻度线,配制1.0 mol/L的NaOH溶液
C.向酸性重铬酸钾溶液中加NaOH,溶液颜色由橙色慢慢变为黄色
D.如图所示,随着空气的通入,试管内液面会慢慢上升至充满整支试管,而后液面又下降