微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 SO2使酸性KMnO4溶液褪色,体现了二氧化硫的
A.氧化性
B.还原性
C.漂白性
D.弱酸性
参考答案:B
本题解析:分析:酸性高锰酸钾能将二氧化硫在水溶液中氧化成硫酸,自身还原为无色的二价锰离子;
解答:酸性高锰酸钾能将二氧化硫在水溶液中氧化成硫酸,自身还原为无色的二价锰离子,是酸性高锰酸钾的氧化性的体现,这里体现的是二氧化硫的还原性,故选:B;
点评:本题考查二氧化硫的性质,掌握性质是解题的关键,难度不大.
本题难度:简单
2、选择题 下列离子方程式正确的是
A.氯化铝溶液中加入过量氨水:AlCl3++4NH3?H2O=AlO2-+4NH4++2H2O
B.将氯气溶于水制备次氯酸:Cl2+H2O2H++C1-+ClO-
C.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+
D.NaHSO4溶液中滴入Ba(OH)2溶液至SO42-完全沉淀:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
参考答案:C
本题解析:分析:A.氨水不能溶解氢氧化铝沉淀;
B.次氯酸为弱酸,在离子反应中应保留化学式;
C.遵循质量守恒定律和电荷守恒;
D.NaHSO4溶液中滴入Ba(OH)2溶液至SO42-完全沉淀,二者的物质的量之比为1:1.
解答:A.氯化铝溶液中加入过量氨水的离子反应为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故A错误;
B.将氯气溶于水制备次氯酸的离子反应为Cl2+H2O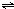 H++C1-+HClO,故B错误;
H++C1-+HClO,故B错误;
C.用FeCl3溶液腐蚀铜线路板的离子反应为Cu+2Fe3+=Cu2++2Fe2+,故C正确;
D.NaHSO4溶液中滴入Ba(OH)2溶液至SO42-完全沉淀的离子反应为H++SO42-+Ba2++OH-=BaSO4↓+H2O,故D错误;
故选C.
点评:本题考查离子反应方程式书写的正误判断,明确发生的化学反应、离子反应的书写方法是解答本题的关键,难度不大.
本题难度:简单
3、选择题 下列反应不能生成FeCl2的是
A.铁和CuCl2溶液反应
B.FeCl3溶液中加入铜粉
C.铁在氯气中燃烧
D.铁和稀盐酸反应
参考答案:C
本题解析:试题分析:A中铁置换铜,产生氯化亚铁,B中反应产生氯化铜和氯化亚铁,C中生成的是三氯化铁而不是氯化亚铁,D中反应生成氯化亚铁和氢气。
考点:常见化学反应
点评:由于氯气氧化性强,所以直接把铁氧化为三价铁。
本题难度:一般
4、选择题 下列气体中无色无味的是
A.SO2
B.Cl2
C.NO2
D.N2
参考答案:D
本题解析:A、SO2有刺激性气味
B、Cl2?浅黄绿色、有刺激性气味
C、NO2红棕色、有味的气体
D、N2是无色无味的气体。故选D。
本题难度:一般
5、选择题 下列叙述正确的是
A.还原性:Na>K
B.热稳定性:NaHCO3>Na2CO3
C.等物质的量的NaHCO3和Na2CO3分别跟足量盐酸反应,消耗HCl的物质的量比为1:2
D.等质量的NaHCO3和Na2CO3分别跟足量盐酸反应,产生CO2的物质的量比为1:2
参考答案:C
本题解析:分析:同主族元素从上到下,元素的金属性逐渐增强,NaHCO3不稳定,加热易分解,与盐酸反应时,Na2CO3+2HCl=2NaCl+H2O+CO2↑(盐酸过量),NaHCO3+HCl=NaCl+H2O+CO2↑,NaHCO3反应剧烈,结合反应的方程式计算和判断.
解答:A.金属性Na<K,元素的金属性越强,对应的单质的还原性越强,故A错误;
B.碳酸氢钠不稳定,加热分解生成碳酸钠和二氧化碳气体,方程式为2NaHCO3 Na2CO3+CO2↑+H2O,故B错误;
Na2CO3+CO2↑+H2O,故B错误;
C.等物质的量的NaHCO3和Na2CO3分别跟足量盐酸反应,分别发生Na2CO3+2HCl=2NaCl+H2O+CO2↑(盐酸过量),NaHCO3+HCl=NaCl+H2O+CO2↑,消耗HCl的物质的量比为1:2,故C正确;
D.等质量的NaHCO3和Na2CO3分别跟足量盐酸反应,NaHCO3物质的量较大,产生CO2的物质的量比为 :
: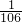 ,故D错误.
,故D错误.
故选C.
点评:该题考查碳酸钠与碳酸氢钠的性质比较,是高考中的常见考点,属于中等难度的试题.试题针对性强,紧扣教材基础知识,有利于培养分析、归纳和总结问题的能力.该题的关键是熟练记住二者的性质差异,然后结合题意灵活运用即可.
本题难度:一般