微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有
[? ]
A.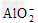 ?
?
B.Cu2+
C.Al3+
D.Mg2+
参考答案:A
本题解析:
本题难度:简单
2、选择题 下列实验现象或分析结论中,正确的是
A.二氧化硫通入品红试液中红色褪去,说明二氧化硫具有还原性
B.利用金属与盐酸反应,可比较铝和镁的金属性强弱
C.向鸡蛋清溶液中加入甲醛溶液,可使蛋白质的溶解度降低而析出
D.制备乙酸乙酯的实验中,可用浓氢氧化钠溶液代替饱和碳酸钠溶液
参考答案:B
本题解析:A、二氧化硫通入品红试液中红色褪去,说明二氧化硫具有漂白性,错误;B、利用金属与盐酸反应,可比较铝和镁的金属性强弱,正确;C、向鸡蛋清溶液中加入甲醛溶液,可使蛋白质变性而析出沉淀,错误;D、乙酸乙酯在氢氧化钠溶液存在的条件下水解较为彻底,制备乙酸乙酯的实验中,不能用浓氢氧化钠溶液代替饱和碳酸钠溶液,错误。
本题难度:一般
3、选择题 近年来,科学家正在探索利用铝粉作为新能源的可能性,以期铝能成为一种石油的取代物.假如铝作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法,你认为哪项是错误的( )
A.铝质轻,便于运输、贮存,且安全
B.在地球上,铝矿资源比较丰富
C.铝燃烧时放出的热量大,且燃烧后新产物对环境的污染容易得到有效的控制
D.现代电解铝的工业技术已为铝作为新能源奠定了重要基础
参考答案:A、因Al为固体,且密度较小,则铝质轻,便于运输、贮存,且安全,故A正确;
B、Al是地壳中含量最多的金属元素,大量存在于矿石中,则铝矿资源比较丰富,故B正确;
C、Al燃烧时放出热量较大,且生成的氧化铝,则对环境的污染容易得到有效的控制,故C正确;
D、电解Al消耗能源,但Al作为新能源提供能量,二者之间没有必然的联系,故D错误;
故选D.
本题解析:
本题难度:一般
4、选择题 质量比为2:3的金属铝分别跟足量稀H2SO4和NaOH溶液反应,则产生的H2的体积比是(?)
A.1:2
B.1:3
C.2:3
D.3:2
参考答案:C
本题解析:Al与酸反应时,有关系式:2Al~3H2,铝与碱反应时仍是2Al~3H2,所以质量相等的Al跟足量酸或碱分别反应,放出等体积(相同状况下)的H2。
本题难度:简单
5、填空题 某同学欲检验抗酸药中是否含有Al(OH)3,操作如下:取药剂3-4片研碎,向样品中加入过量的盐酸,过滤,得澄清溶液,向澄清溶液中滴加NaOH溶液,观察到有白色沉淀,继续加过量NaOH溶液,白色沉淀又溶解。你能得出该抗酸药中是否含有Al(OH)3____(填“含”或“不含”),请写出有关反应的化学方程式:①Al(OH)3+3HCl=AlCl3+3H2O;②________________;③________________。
参考答案:含;②AlCl3+3NaOH=Al(OH)3↓+3NaCl;③Al(OH)3+NaOH=NaAlO2+2H2O
本题解析:
本题难度:一般