微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是
[? ]
A.CH3OH(l)+3/2O2(g)== CO2(g)+2H2O(l) △H=+725.8 kJ/mol
B.2CH3OH(l)+3O2(g)== 2CO2(g)+4H2O(l) △H=-1452 kJ/mol
C.2CH3OH(l)+3O2(g)== 2CO2(g)+4H2O(l) △H=-725.8 kJ/mol
D.2CH3OH(l)+3O2(g)== 2CO2(g)+4H2O(l) △H=+1452 kJ/mol
参考答案:B
本题解析:
本题难度:一般
2、简答题 沼气是一种廉价的能源.农村富有秸秆、杂草等废弃物,它们经微生物发酵之后,便可以产生沼气,可以用来点火做饭.
(1)已知:(C6H10O5)n+nH2O?3nCO2+3nCH4;△H<0.请评价这个反应的实际价值与意义:______.(至少两点)
(2)煤的主要成分是碳,写出煤和沼气中的主要成分燃烧过程的化学方程式:______,______并指出哪一种燃料对环境的污染小?______.
(3)8g甲烷完全燃烧生成液态水时能放出445kJ的热量,写出甲烷燃烧生成液态水时的热化学反应方程式:______
(4)若建立沼气发电站,则可以实现把______转化为电能.
参考答案:(1)农村富有秸秆、杂草等废弃物,它们经微生物发酵之后,便可以产生沼气,可以用来点火做饭.
故答案为:有效的利用生物质能,获得气体燃料;为农业生产提供了优良肥料;改善农村环境卫生.
(2)煤的主要成分是碳,煤燃烧过程的化学方程式:C+O2?点燃?.?CO2,沼气燃烧过程的化学方程式:CH4+2O2?点燃?.?CO2+2H2O,沼气对环境污染小.
故答案为:C+O2??点燃?.?CO2;CH4+2O2??点燃?.?CO2+2H2O;沼气对环境污染小;
(3)8g甲烷完全燃烧生成液态水时能放出445kJ的热量,8g甲烷的物质的量是0.5mol,1mol甲烷完全燃烧生成液态水时能放出890kJ的热量,故甲烷燃烧生成液态水时的热化学反应方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890KJ?moL-1,故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890KJ?moL-1;
(4)沼气中存在的是生物质能,故建立沼气发电站,则可以实现把生物质能转化为电能.
故答案为:生物质能.
本题解析:
本题难度:一般
3、填空题 实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求,依靠理论知识做基础。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: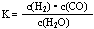 它所对应的化学反应为:_____________________________
它所对应的化学反应为:_____________________________
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g);ΔH=-90.8 kJ/mol
CH3OH(g);ΔH=-90.8 kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g);ΔH=-23.5 kJ/mol
CH3OCH3(g)+H2O(g);ΔH=-23.5 kJ/mol
③CO(g)+ H2O(g) CO2(g)+H2(g);ΔH=-41.3 kJ/mol
CO2(g)+H2(g);ΔH=-41.3 kJ/mol
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH="__________" ,
CH3OCH3(g)+CO2(g)的ΔH="__________" ,
二甲醚(CH3OCH3)直接作燃料电池具有启动快,效率高等优点,若电解质为酸性,该电池的负极反应为_____________________________。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
该反应的正反应方向是_________反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为:________。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应 N2O4(g) 2NO2(g) △H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是___________。
2NO2(g) △H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是___________。
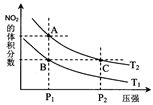
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点的化学平衡常数:A>C
(5)NO2可用氨水吸收生成NH4NO3。25℃时,将m mol NH4NO3溶于水,溶液显酸性,向该溶液滴加n L氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将______(填”正向”“不”或“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数取Kb=2X10-5 mol·L-1)
(6)某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如右图,电极为多孔的材料能吸附气体,同时也能使气体与电解质溶液充分接触.
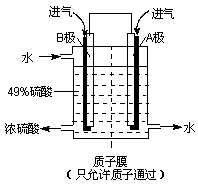
①溶液中H+的移动方向由______ 极到______极;(用A、B表示)
②B电极的电极反应式为__________________________。
参考答案: (1) C(s)+H2O(g)  CO(g)+ H2 (g) (1分)
CO(g)+ H2 (g) (1分)
(2)-246.4KJ/mol (2分) CH3OCH3-12e-+3H2O=2CO2+12H+ (2分)
(3)放热(1分) 75% (2分)
(4)D (2分) (5) 逆向 (2分) m/200n (2分)
(6)①B (1分) A (1分) ②SO2+2H2O-2e-=SO42-+4H+ (2分)
本题解析:(1)煤生成水煤气的反应为C(s)+H2O(g)  CO(g)+ H2 (g)。
CO(g)+ H2 (g)。
(2)观察目标方程式,应是①2+②+③,故△H=2△H1+△H2+△H3=-246.4kJ? mol -1;负极以CH3OCH3和H2O作为原料,失去电子生成CO2和 H+
(3)升高温度,平衡常数减小,平衡左移,故正反应是放热反应;
CO(g)+H2O(g)?CO2(g)+H2(g) 反应是一定体积容器中设为1L,反应量为x
起始量(mol) 0.02 0.02 0 0
变化量(mol) x x x x
所得量(mol)0.02-x 0.02-x x x
根据K= c(CO2) ×c(H2)/( c(CO) × c(H2O) ),得 x2/(0.02-x)2=9,得x=0.015mol
转化率为0.015/0.02×100%=75%
(4)A、从A点到C点,温度相同,但是P2>P1,压强大,化学反应速率快,因此C>A
B、C点的压强大,容器体积小,浓度高,因此C点颜色深。
C、B,C两点的纵坐标数据相同,也就是各气体的体积分数相同,物质的量相同,其平均相对分子质量也相同
D、 该反应为吸热反应(可视为N2O4(g)=NO2(g)+NO2(g),为分解反应,吸热过程)。B到A的过程生产物NO2(g)的体积分数增多,反应正向移动,可以采用加热的方法。
(5)滴加氨水的过程中,将抑制水的电离。理由是加碱将抑制水的电离,故水的电离平衡将 逆向
.由电荷守恒得:n(NH4+) +n(H+)=n(NO3-) +n(OH-),
由于溶液呈中性,所以n(H+)= n(OH-),n(NH4+) =n(NO3-) =m
NH3H2O=(可逆)=NH4+ +OH-
X m /n 10-7
NH3H2O的店里平衡常数 Kb="c(" NH4+)×c( OH-)/C(NH3H2O)="[" ( m/n )×10-7 ]/x=2×10-5mol·L-1
所以x= m/200n mol·L-1
(6) 阳离子向正极移动,所以H+从B极向A极移动。
根据B极的产物可以看出B极发生氧化反应,是负极,电极方程式为SO2+2H2O-2e-=SO42-+4H+。
考点:考查化学平衡知识
本题难度:困难
4、选择题 己知:HCN(aq)与NaOH(aq)反应的△H=-12.1kJ/mol;HCl(aq)与NaOH(aq)反应的△H= -55.6kJ/mol。 则HCN在水溶液中电离的△H等于 ( )
A.-67.7 kJ/mol
B.-43.5 kJ/mol
C.+43.5 kJ/mol
D.+67.7kJ/mol