微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在25℃时,1 mol/L的NH4Cl、CH3COONH4、NH4HSO4、NH4HCO3的溶液中,测得其NH4+浓度分别为a、b、c、d(单位为mol/L),下列判断正确的是(相同条件下氨水和醋酸的电离程度相同)
A.a=b=c=d
B.a=c>b=d
C.c>a>d>b
D.c>a>b>d
参考答案:D
本题解析:
本题难度:一般
2、选择题 下列溶液,阴离子总浓度最大的是
A.0.2 mol / L NaCl
B.0.1 mol / L Ba(OH)2
C.0.2 mol / L K2S
D.0.2 mol / L (NH4)2SO4
参考答案:C
本题解析:本题主要考查电离和水解情况;电离出来的阴离子浓度A、B、C、D分别为0.2、0.2、0.2、0.2;由于S2-水解S2-+H2O HS-+OH-;故离子数目增多,答案选C。
HS-+OH-;故离子数目增多,答案选C。
本题难度:简单
3、选择题 在0.1 mol·L-1Na2S溶液中存在着多种离子和分子,下列关系不正确的是
A.c(Na+)+c(H+)=c(HS-)+c(OH-)+2c(S2-)
B.c(Na+)+c(H+)=c(HS-)+c(OH-)+c(S2-)
C.c(Na+)=2c(S2-)+2c(HS-)+2c(H2S)
D.c(OH-)=c(H+)+c(HS-)+2c(H2S)
参考答案:B
本题解析:在电解质溶液里由电荷守恒得:
c(Na+)+c(H+)=c(HS-)+c(OH-)+2c(S2-)
在电解质溶液里由物料守恒得:
c(Na+)=2c(S2-)原=c(S2-)+c(HS-)+c(H2S)
即:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S)
由质子守恒得:
c(OH-)=c(H+)+c(HS-)+2c(H2S)
本题难度:困难
4、选择题 现有a?mol/L?NaX和b?mol/L?NaY两种盐溶液.下列说法不正确的是(若是溶液混合,则忽略混合时的体积变化)( ? )
A.若a=b且pH(NaX)>pH(NaY),则酸性HX>HY
B.若a=b且c(X-)=c(Y-)+c(HY),则酸性HX>HY
C.若a>b且c(X-)=c(Y-),则酸性HX<HY
D.若a=0.1mol/L且两溶液等体积混合,则c(X-)+c(HX)=0.1mol/L
参考答案:AD
本题解析:
本题难度:一般
5、填空题 (14分)运用化学反应原理分析解答以下问题
(1)已知: ①CO(g)+2H2(g)  CH3OH(g) △Hl= -91kJ·mol-l
CH3OH(g) △Hl= -91kJ·mol-l
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2= -24 kJ·mol-l ③CO(g) +H2O(g)
CH3OCH3(g)+H2O(g) △H2= -24 kJ·mol-l ③CO(g) +H2O(g)  CO2(来源:91 考试网g)+H2(g) △H3= -41 kJ·mol-l
CO2(来源:91 考试网g)+H2(g) △H3= -41 kJ·mol-l
且三个反应的平衡常数依次为K1、K2、K3
 则反应 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H= .
则反应 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H= .
化学平衡常数K= (用含K1、K2、K3的代数式表示)。
(2)一定条件下,若将体积比为1:2的CO和H2气体通入体积一定的密闭容器中发生反应
 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g),下列能说明反应达到平衡状态是 。
3CO(g) +3H2(g) CH3OCH3(g) +CO2(g),下列能说明反应达到平衡状态是 。
a.体系压强保持不变 B.混合气体密度保持不变
c. CO和H2的物质的量保持不变 d.CO的消耗速度等于CO2的生成速率
(3)氨气溶于水得到氨水。在25℃下,将x mol.L-l的氨水与y mol.L-1的盐酸等体积混合,反应后溶液显中性,则c(NH4+)____c(Cl-)(填“>”、“<”、“=”);用含x和y的代数式表示出氨水的电离平衡常数 .
(4)科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池反应式为:4NH3+3O2 = 2N2+6H2O,电解质溶液应显 (填“酸性”、“中性”、“碱性”),
写出正极的电极反应方程式 .
参考答案:(每空2分,共14分)
(1)-247KJ·mol-1 K12·K2·K3
(2)a·c
(3) = K=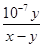 mol·L-1
mol·L-1
(4)碱性 O2+2H2O+4e-=4OH-
本题解析:(1)根据盖斯定律得3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H=①×2+②+③=△Hl×2+△H2+△H3=-247KJ·mol-1,平衡常数K= K12·K2·K3
CH3OCH3(g) +CO2(g) △H=①×2+②+③=△Hl×2+△H2+△H3=-247KJ·mol-1,平衡常数K= K12·K2·K3
(2)a、容器体积固定,3CO(g) +3H2(g) CH3OCH3(g) +CO2(g)是反应前后气体压强发生改变的可逆反应,所以体系压强保持不变时达平衡状态,正确;b、容器体积固定,根据质量守恒定律,得气体的密度始终不变,所以不能作为平衡状态到达的标志,错误;c、反应开始时,CO和H2的物质的量一直减少,当CO和H2的物质的量保持不变,不再减少时证明已达平衡状态,正确;d、CO的消耗速率任何状态都不等于CO2的生成速率,错误,答案选ac;
CH3OCH3(g) +CO2(g)是反应前后气体压强发生改变的可逆反应,所以体系压强保持不变时达平衡状态,正确;b、容器体积固定,根据质量守恒定律,得气体的密度始终不变,所以不能作为平衡状态到达的标志,错误;c、反应开始时,CO和H2的物质的量一直减少,当CO和H2的物质的量保持不变,不再减少时证明已达平衡状态,正确;d、CO的消耗速率任何状态都不等于CO2的生成速率,错误,答案选ac;
(3)根据电荷守恒定律,盐酸与氨水混合后的溶液显中性,则c(H+)=c(OH-),c(Cl-)+ c(OH-)=c(NH4+)+c(H+),所以c(Cl-)=c(NH4+);在25℃下,中性溶液中c(H+)= c(OH-)=1×10-7mol/L,若盐酸与氨水的浓度相等,则等体积混合后生成氯化铵溶液显酸性,而实际溶液显中性,说明氨水的浓度大于盐酸的浓度,氨水过量,设二者的体积均为1L,与盐酸反应完剩余氨水的物质的量(x-y)mol,一水合氨的浓度为(x-y)/2mol/L,c(NH4+)=c(Cl-)=y/2mol/L,则氨水的电离平衡常数K= c(OH-)c(NH4+)/ c(NH3·H2O)= 1×10-7mol/L×y/2mol/L/(x-y)/2mol/L=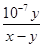 mol·L-1,
mol·L-1,
(4)根据电池反应式为:4NH3+3O2 =2N2+6H2O,判断氨气发生氧化反应,氧气发生还原反应,氨气失电子成为氮气和氢离子,所以电解质溶液应显碱性,产物中才能生成水;因为电解质溶液为碱性,所以正极是氧气的还原反应,氧气得电子与水结合生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-
考点:考查盖斯定律的应用 ,化学平衡状态的判断,化学平衡常数的计算,原电池反应原理的应用
本题难度:困难