微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某同学设计出如下装置成功的证明了Cu和Ag的金属活动性顺序。请你原电池原理和实验装置,完成下列实验报告。

实验目的:探究Cu和Ag的金属活动性顺序
(1)电极材料:正极: ;负极: ;
硝酸银溶液的作用是 。
(2)写出电极反应式:
正极: ;负极: 。
(3)实验现象: 。
(4)实验结论: 。
参考答案:(12分)(1)银片(1分)、铜片(1分);参与氧化还原反应和导电(2分)
(2)正极:2Ag+ + 2e- =2Ag(2分),负极:Cu
本题解析:
本题难度:一般
2、选择题 磷酸铁锂电池(LiFePO4,简称LFP)的电池的内部结构如图所示。左边是橄榄石结构的磷酸铁锂材料作为电池的正极,由铝箔与电池正极连接,中间是聚合物的隔膜,它把正极与负极隔开,但锂离子Li+可以通过而电子e-不能通过,右边是由碳(石墨)组成的电池负极,由铜箔与电池的负极连接。电池的上下端之间是电池的电解质,电池由金属外壳密闭封装。下列关于电池的说法不正确的
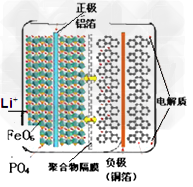
[? ]
A. LFP电池在充电时,正极中的锂离子Li+通过聚合物隔膜向负极迁移
B. LFP电池放电时,锂离子从负极中脱出来,经过电解液,穿过隔膜回到正极材料中
C. 负极反应:C6Li-xe-==C6Li(1-x)+xLi+?(C6Li表示锂原子嵌入石墨形成复合材料)
D.?正极反应:Li(1-x)FePO4?+?xLi+?==?Li+?x?e-+FePO4?(LiMO2表示含锂的过渡金属氧化物?)?
参考答案:D
本题解析:
本题难度:一般
3、选择题 固体电解质是具有与强电解质水溶液的导电性相当的一类无机固体。这类固体通过其中的离子迁移进行电荷传递,因此又称为固体离子导体。目前固体电解质在制造全固态电池及其它传感器、探测器等方面的应用日益广泛。如RbAg4I5晶体,其中迁移的物种全是Ag+,室温导电率达0.27Ω-1·cm-1。利用RbAg4I5晶体,可以制成电化学气敏传感器,下图是一种测定O2含量的气体传感器示意图。被分析的O2可以透过聚四氟乙烯薄膜,由电池电动势变化可以得知O2的含量。在气体传感器工作过程中,下列变化肯定没有发生的是
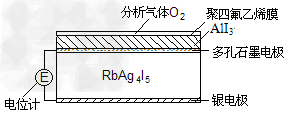
[? ]
A.I2+2Rb++2e-=2RbI?
B.I2+2Ag++2e-=2AgI
C.Ag-e-=Ag+?
D.4AlI3+3O2==2Al2O3+6I2
参考答案:A
本题解析:
本题难度:一般
4、填空题 (15分)甲醇(CH3OH)是一种可再生能,具有开发和应用的广阔前景,工业上一般可采用如下反应合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)t℃时,往1L密闭容器中充入1mol CO和2molH2。10min后,反应达到平衡,并测得CH3OH(g)的浓度为0.8 mol·L-1。
①该时间内反应速率v(H2) =____。t℃时,该反应的化学平衡常数K= (mol·L-1)-2
②下列各项中,能说明该反应已达到平衡的是_____________(填序号)
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,测得v正(CO) =v逆(CH3OH)
c.恒温、恒容条件下,容器内的气体密度不发生变化
d.一定条件下,单位时间内消耗2 mol H2,同时生成1 mol CH3OH(g)
(2)下图是该反应在T1 、T2温度下CO的转化率随时间变化的曲线。
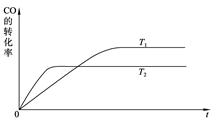
①该反应的焓变ΔH____0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1____________K2(填“>”、“<”或“=”)。
③若保持容器容积不变,下列措施可增加甲醇产率的是______________。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =-a kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH =-b kJ·mol-1
则,CH3OH(l)+O2(g) =CO(g)+2H2O(g) ΔH=____________kJ·mol-1。
(4)我国在甲醇燃料电池技术方面已获得重大突破。甲醇燃料电池的工作原理如图所示。
①该电池工作时,b口通入的物质为______。
②该电池正极的电极反应式为 。
参考答案:(1)①0.16 mol·L·min-1 (2分) 25 (mol·L-1)-2(2分)
②ab(2分,缺1项扣1分,有错项0分)
(2)①<(1分)②>(1分)③b(2分)
(3)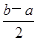 (2分)
(2分)
(4)①CH3OH(1分)②O2 + 4e-+ 4H+ = 2H2O(2分)
本题解析:(1)①
所以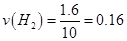 mol·L·min-1;
mol·L·min-1;
化学平衡常数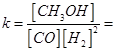 25 (mol·L-1)-2;②该反应为体积可变的反应,所以恒温、恒容条件下,容器内的压强不发生变化,反应达到平衡状态;v正(CO) =v逆(CH3OH),正逆反应速率相等,达到平衡状态;恒温、恒容条件下,
25 (mol·L-1)-2;②该反应为体积可变的反应,所以恒温、恒容条件下,容器内的压强不发生变化,反应达到平衡状态;v正(CO) =v逆(CH3OH),正逆反应速率相等,达到平衡状态;恒温、恒容条件下,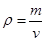 ,V不变,m不所以密度始终不变,变容器内的气体密度不发生变化,不一定平衡;单位时间内消耗2 mol H2,同时生成1 mol CH3OH(g),无法判断逆反应的速度,所以不一定平衡;
,V不变,m不所以密度始终不变,变容器内的气体密度不发生变化,不一定平衡;单位时间内消耗2 mol H2,同时生成1 mol CH3OH(g),无法判断逆反应的速度,所以不一定平衡;
(2)①根据图像,先拐先平,所以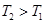 ,即升高温度CO的转化率减小,平衡左移,所以ΔH<0;②
,即升高温度CO的转化率减小,平衡左移,所以ΔH<0;②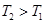 升高温度,平衡左移,所以升高温度平衡常数减小;③升高温度平衡左移,甲醇产率降低;将CH3OH(g)从体系中分离,平衡右移,甲醇产率增大;使用合适的催化剂,平衡不移动,甲醇产率不变;充入He,使体系总压强增大,平衡不移动,甲醇产率不变。
升高温度,平衡左移,所以升高温度平衡常数减小;③升高温度平衡左移,甲醇产率降低;将CH3OH(g)从体系中分离,平衡右移,甲醇产率增大;使用合适的催化剂,平衡不移动,甲醇产率不变;充入He,使体系总压强增大,平衡不移动,甲醇产率不变。
(3)根据盖斯定律CH3OH(l)+O2(g) =CO(g)+2H2O(g) ΔH=(①—②)÷2=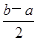 kJ·mol-1;
kJ·mol-1;
(4)根据电池内H+右移,所以左侧为负极发生氧化反应,b孔通入CH3OH;正极通入氧气,正极反应式为O2 + 4e-+ 4H+ = 2H2O 。
考点:本题考查平衡移动、平衡常数、燃料电池。
本题难度:困难
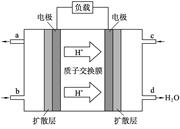
5、选择题 如图为氢氧燃料电池示意图,按此图的提示,下列叙述不正确的是(?)
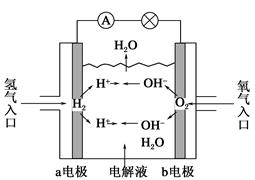
A.a电极是负极
B.b电极的电极反应为:4OH--4e-=2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
参考答案:B
本题解析:燃料电池是一种高效、环境友好的具有应用前景的绿色电源,不需要将还原剂和氧化剂全部储藏在内部的新型发电装置。在燃料电池中,燃料(H2)从负极充入,发生氧化反应,故A、C、D正确。在B中,O2在正极上发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,故B错误。
本题难度:一般