微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在溶液中不能与Fe3+大量共存的离子是( )
A.OH-
B.Fe2+
C.SO42-
D.H+
参考答案:A.因OH-与Fe3+结合生成沉淀,则不能共存,故A选;
B.因离子之间不反应,能共存,故B不选;
C.因离子之间不反应,能共存,故C不选;
D.因离子之间不反应,能共存,故D不选;
故选A.
本题解析:
本题难度:简单
2、选择题 常温下,下列各组离子在指定溶液中一定能大量共存的是(?)
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
C.c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br -
D.加入苯酚显紫色的溶液:K+、NH4+、Cl-、I-
参考答案:C
本题解析:A.NO3-、H+、Fe2+会发生氧化还原反应而不能大量共存。错误。B.甲基橙呈红色的溶液是酸性溶液,H+和AlO2-发生离子反应,不能共存。错误。C.c(H+)=10-12 mol·L-1的溶液是碱性溶液,离子不会发生任何反应。正确。D.加入苯酚显紫色的溶液中含有Fe3+,Fe3+和I-发生离子反应:2Fe3++2I-=2Fe2++I2不能共存。
本题难度:一般
3、选择题 常温下,测得某无色溶液中由水电离出的C(H+)=1×10-13mol·L-1,则该溶液中一定能共存的离子组是
A.AlO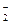 、NO
、NO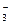 、Na+、Cl-
、Na+、Cl-
B.Mg2+、SO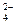 、Na+、CIO-
、Na+、CIO-
C.Fe3+、NO3-、K+、SO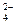
D.Ba2+、K+、NO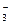 、Cl-
、Cl-
参考答案:D
本题解析:略
本题难度:简单
4、选择题 室温时,下列各组离子在指定溶液中可以大量共存的是( )
A.由水电离出的c(H+)=10-12mol/L的溶液中:Na+、Ba2+、HCO
、C1-
B.无色透明溶液中:K+、Cu2+、SO、Na+
C.含有大量AlO2-的溶液中:Na+、OH-、Cl-、CO
D.能使pH试纸显红色的溶液中:Na+、ClO-、Fe2+、SO
参考答案:A.由水电离出的c(H+)=10-12mol/L的溶液,为酸或碱溶液,HCO3-既能与酸反应又能与碱反应,则一定不能共存,故A错误;
B.Cu2+为蓝色,与无色溶液不符,故B错误;
C.含有大量AlO2-的溶液,显碱性,该组离子之间不反应,能共存,故C正确;
D.能使pH试纸显红色的溶液,显酸性,Fe2+、ClO-、H+离子之间发生氧化还原反应,则不能共存,故D错误;
故选C.
本题解析:
本题难度:一般
5、选择题 将足量的CO2慢慢通入一定体积的NaOH溶液中,溶液的pH随CO2的体积(已经折算成标准状况)的变化曲线如图所示(不考虑过量的CO2在水中的溶解和反应过程中溶液体积的变化),则下列说法不正确的是(?)
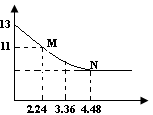
A.NaOH溶液的物质的量浓度为0.1mol/L
B.NaOH溶液的体积为2L
C.M点离子浓度的大小关系满足c(HCO3-)>c(CO32-)
D.M、N点对应的纵坐标均大于7
参考答案:C
本题解析:本题主要考查CO2与NaOH反应的顺序与产物的对应关系,并根据图象数据进行相应的计算。在通入CO2气体之前,pH=13,说明c(NaOH)=0.1mol·L-1;在N点,PH不再发生变化,说明NaOH完全消耗,反应为NaOH+CO2=NaHCO3,因为n(CO2)=0.2mol,所以n(NaOH)= n(CO2)=0.2mol,V(NaOH)=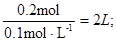 ?在M点,n(CO2)=0.1mol,发生反应为2NaOH+CO2=Na2CO3+H2O,CO32-+H2O
?在M点,n(CO2)=0.1mol,发生反应为2NaOH+CO2=Na2CO3+H2O,CO32-+H2O HCO3-+OH-;CO32-水解产生HCO3-,所以c(CO32-)>c(HCO3-);在N点,HCO3-+H2O
HCO3-+OH-;CO32-水解产生HCO3-,所以c(CO32-)>c(HCO3-);在N点,HCO3-+H2O H2CO3+OH-,溶液呈碱性。
H2CO3+OH-,溶液呈碱性。
本题难度:一般