微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 CaC2和MgC2都是离子化合物,下列叙述正确的是
A.MgC2和CaC2都不能跟水反应生成乙炔
B.C22-的电子式为[∶C┇┇C∶]2-
C.CaC2在水中以Ca2+和C22-形式存在
D.MgC2熔点低,可能在100℃以下
参考答案:B
本题解析:略
本题难度:一般
2、推断题 A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含一种金属元素。A和D最外层电子数相 同;B、C和E在周期表中相邻,且C、E同主族。B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的化合物甲和乙(相对分子质量甲<乙)。
请回答下列问题:
(1)甲的电子式为___________;写出乙的一种用途____________。
(2)用某种废弃的金属易拉罐和碳棒作电极,以A、C、D 组成的化合物溶液为电解质溶液,构成原电池,写出负极的电极反应式________________。
(3)向A、B、C三种元素组成的某盐溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为________________。反应后的溶液中浓度最大的离子为__________(写离子符号)。
(4)写出C和D形成的化合物与EC2发生氧化还原反应的化学方程式,并标出电子转移的方向和数目
___________________。
参考答案:(1) ;杀菌、消毒
;杀菌、消毒
(2)Al+4OH--3e-=AlO2-+2H2O?
(3)NH4NO2+AgNO3=AgNO2↓+NH4NO3;NO3- (4)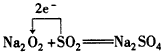
本题解析:
本题难度:一般
3、简答题 某学习小组研究同周期元素性质递变规律时,设计并进行了下列实验(表中的“实验步骤”与“实验现象”前后不一定是对应关系).
| 实验步骤 | 实验现象
①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液
A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色.
②向新制得的Na2S溶液中滴加新制的氯水
B.有气体产生,溶液变成浅红色
③将一小块金属钠放入滴有酚酞溶液的冷水中
C.剧烈反应,迅速产生大量无色气体
④将镁条投入稀盐酸中
D.反应不十分剧烈;产生无色气体.
⑤将铝条投入稀盐酸中
E.生成白色胶状沉淀,继而沉淀消失
⑥向A1Cl3溶液中滴加NaOH溶液至过量
F.生成淡黄色沉淀.
|
(1)请将各实验步骤对应的实验现象填写入下表中:
| 实验步骤 | ① | ② | ③ | ④ | ⑤ | ⑥
实验现象(填A~F)
▲
▲
▲
?C
D
▲
|
(2)此实验可得出的结论是:
金属性比较:______,非金属性比较:______;
(3)请写出反应②的离子方程式______.
参考答案:(1)①镁与热水反应,生成氢气和氢氧化镁,反应后溶液呈碱性,故现象为有气体产生,溶液变成浅红色;
②Na2S具有还原性,氯气具有氧化性,二者发生氧化还原反应生成单质硫,故现象为生成淡黄色沉淀;
③钠的密度比水小,与水剧烈反应生成氢气和氢氧化钠溶液,故现象为浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色;
④镁为活泼金属,与盐酸发生置换反应,故现象为剧烈反应,迅速产生大量无色气体;
⑤铝能与盐酸反应,较镁不活泼,故现象为反应不十分剧烈;产生无色气体;
⑥A1Cl3与NaOH反应生成A1(OH)3,A1(OH)3具有两性,能与NaOH反应生成可溶于水的偏铝酸钠,故现象为生成白色胶状沉淀,继而沉淀消失.
故答案为:
实验步骤①②③④⑤⑥实验现象(填A~F)BFA?CDE(2)Na与冷水反应剧烈,Mg与热水反应,与酸剧烈反应,而铝与酸缓慢反应,金属与水或酸反应越剧烈,金属越活泼,金属性越强;向新制得的Na2S溶液中滴加新制的氯水,生成淡黄色沉淀,说明氯气可置换出硫,则氯气的氧化性大于硫,说明氯元素的非金属大于硫,故答案为:Na>Mg>Al;Cl>S;
(3)向新制得的Na2S溶液中滴加新制的氯水,生成淡黄色沉淀,说明氯气可置换出硫,
反应的离子方程式为S2-+Cl2=S↓+2Cl-,
故答案为:S2-+Cl2=S↓+2Cl-.
本题解析:
本题难度:一般
4、填空题 A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5个,D的最外层电子数是F的2倍,C和D的最外层电子数之和为11。
请回答下列问题:
(1)以上八种元素中非金属所形成的最简单气态氢化物稳定性最弱的是(填化学式) ________, E、F、H所形成的简单离子的半径由大到小的顺序为(用离子符号表示)______ >________ > _______。
(2)一定条件下,A的单质气体与C的单质气体充分反应生成 W气体,W的结构式________。由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为_____。固体化合物E2D2与化合物E2H的水溶液按物质的量比1︰1反应生成单质H的离子方程式为 ________。
(3)G是非金属元素,其单质在电子工业中有重要应用,请写出G的最高价氧化物与B的单质在高温下发生置换反应的化学反应方程式___________ 。
(4)在10 L的密闭容器中,通入2 mol的HD2气体和1 mol D2的气体单质,一定条件下反应后生成HD3气体,当反应达到平衡时,单质D的浓度为0.01 mol·L-1,同时放出约177KJ的热量,则平衡时HD2的转化率为_______;该反应的热化学方程式为____________ 。
参考答案:(1)SiH4;S2->Na+>Al3+?
(2) ;
; 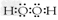 ;Na2O2+2H2O+S2- = S↓+ 2Na+ + 4OH-?
;Na2O2+2H2O+S2- = S↓+ 2Na+ + 4OH-?
(3)SiO2+ 2C  Si + 2CO↑
Si + 2CO↑
(4)90%;2SO2(g)+O2(g)  2SO3(g);△H=-196.7kJ·mol-1
2SO3(g);△H=-196.7kJ·mol-1
本题解析:
本题难度:一般
5、选择题 下列物质与水反应最剧烈的是( )
A.Li
B.Na
C.K
D.Rb
参考答案:Li、Na、K、Rb四种元素位于周期表同一主族,同主族元素从上到下元素的金属性逐渐增强,元素的金属性越小,对应单质与水反应越剧烈,Rb的非金属性最强,则与水反应最剧烈,
故选D.
本题解析:
本题难度:一般