微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 现有以下反应中,①铁丝在氧气中燃烧 ②加热碳和氧化铜的混合物③碳酸钠和硫酸反应 ④加热高锰酸钾固体 ⑤锌和稀硫酸反应 ⑥硫酸钠溶液和氯化钡溶液混合。属于离子反应的有? (填各反应的序号,下同),属于氧化还原反应的? 。
参考答案:③⑤⑥;①②④⑤
本题解析:
本题难度:简单
2、实验题 某溶液中可能含有Na+,NH4+,Ba2+,SO42-,I一,SO32-中的几种,已知各离子浓度均为0.1mol/L,且溶液呈电中性。取样品分别进行实验:
①用pH试纸检测,溶液显弱酸性;
②加溴水,再加淀粉溶液均无明显现象;
据此推断该溶液中含有的离子为?。
参考答案:(3分)Na+? NH4+?SO42-
本题解析:①说明无SO32-离子,一定有NH4+离子;②说明无I一离子。溶液呈电中性说明含有阴离子SO42-,无Ba2+离子。根据溶液呈电中性计算知,溶液中还有Na+离子。故该溶液中含有的离子为Na+、NH4+、SO42-。
点评:本题考查的是无机离子的检验的知识,题目难度中,对实验现象分析透彻是解题的关键。
本题难度:一般
3、填空题 (11分)学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3—、Cl—、MnO4—、SO42-等离子中的几种离子。
①经实验可知溶液明显呈酸性。
②取10mL该溶液于试管中滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲,向滤液中加入AgNO3溶液未见沉淀产生。
③另取少量该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当沉淀增加到一定量后开始产生气体丙,最后沉淀完全溶解。
(1)写出气体丙的电子式___________________。
(2)该溶液中一定不含有:___________________(填离子的化学式)离子,一定含有的离子有___________(填离子的化学式)。
(3)在这些不存在的离子中,有一种离子在酸性环境中与SO2反应,试写出该反应的离子方程式:________________________。
(4)请设计实验方案,检验该试液中是否存在可能含有的离子____________________。
(5)为确定上述溶液中所含的各种离子的物质的量,取100mL上述溶液并向其中加入Na2O2固体,产生的沉淀和气体与所加Na2O2固体物质的量的关系曲线如图Ⅰ:该溶液中可能存在的离子的物质的量为________mol。
参考答案:(1)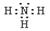 ?(2)MnO4-、HCO3-、Cl-;? NH4+、Al3+、SO42-
?(2)MnO4-、HCO3-、Cl-;? NH4+、Al3+、SO42-
(3)2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+
(4)焰色反应,用洁净的铂丝蘸取试样在无色火焰上灼烧, 透过蓝色钴玻璃,观察火焰颜色,若紫色,则含有K+。?(5)0.1
本题解析:无色溶液,则MnO4-一定不存在,根据①溶液呈酸性,则HCO3-一定不存在,根据②可知溶液中一定有SO42-,且SO42-为0.03mol,一定没有Cl-,根据④可以确定溶液中一定有NH4+和Al3+。
据图可知加入Na2O20.15mol,沉淀达到最大值,则Al3+为0.1mol,Na2O2从0.15mol增至0.25mol是与NH4+反应产生氨气,则NH4+为0.2mol,根据溶液中电荷守恒,一定有K+且为0.1mol。
点评:本题综合性强,主要锻炼学生的推断能力,难度较大,尤其最后的计算。
本题难度:困难
4、选择题 25℃时,某物质的水溶液中由水电离出的c(H+)=1×10-12mol/L,该溶液中一定不能大量存在的离子是
A.NH4+
B.HCO3-
C.SO32-
D.NO3-
参考答案:B
本题解析:分析:25℃时,某物质的水溶液中由水电离出的c(H+)=1×10-12mol/L,为酸或碱溶液,根据离子之间不能结合生成水、气体、沉淀等,则能大量共存,以此来解答.
解答:25℃时,某物质的水溶液中由水电离出的c(H+)=1×10-12mol/L,为酸或碱溶液,
A.酸溶液中氢离子与铵根离子不反应,能共存,故A不选;
B.HCO3-既能与酸反应又能与碱反应,一定不能共存,故B选;
C.碱溶液中离子之间不反应,能共存,故C不选;
D.无论酸或碱溶液中离子之间不反应,能共存,故D不选;
故选B.
点评:本题考查离子的共存,明确习题中的信息是解答本题的关键,熟悉复分解反应发生的条件即可解答,题目难度不大.
本题难度:困难
5、填空题 某强酸性溶液X中含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SiO32-、SO42-、NO3-中的一种或几种离子。为确定溶液X的成分,进行如下实验:
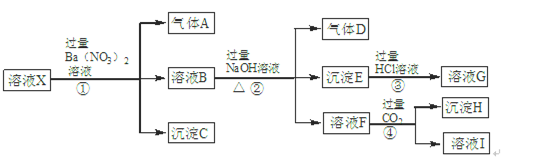
根据以上信息,请回答下列问题:
(1)溶液X中肯定不含有的离子是?,不能确定是否含有的离子是?,若要确定是否含有这种离子,最可靠方法是:?
?。
(2)溶液I中所含溶质有?(填化学式)。
(3)步骤①②③④中,发生符合“强酸制弱酸”反应的步骤是?(填序号)。
(4)步骤①中生成气体A的离子方程式是?。
参考答案:(1)Ba2+、CO32-、SiO32-、NO3- (每个1分,共4分)?Fe3+(1分)
取少量X溶液于试管中,在其中滴加几滴KSCN溶液,若溶液不显血红色则说明没有Fe3+,若显血红色则说明含有Fe3+(2分)
(2)NaNO3、NaHCO3、Ba(NO3)2?(CO2、H2CO3不作要求)(每个1分,共3分) ?
(3)④(1分)?(4)3Fe2++NO3- +4H+=3Fe3++NO↑+2H2O (2分)
本题解析:(1)题干中强酸性溶液中一定不含CO32-、SiO32-;NO3-与Fe2+不能同时存在;根据转化关系中X溶液中加入过量硝酸钡生成气体沉淀和溶液的反应,依据离子性质推断溶液中一定含Fe2+,一定不含NO3?;酸性溶液中硝酸根离子具有强氧化性,加入Ba(NO3)2后得到气体A为NO,D为NO2;沉淀C为硫酸钡,判断溶液中一定含SO42-;根据离子共存判断原溶液中一定不含Ba2+;溶液B中一定含有Fe3+;B溶液和过量氢氧化钠反应生成气体、沉淀、溶液,推断原溶液中一定含NH4+;生成的沉淀E是Fe(OH)3;与碱反应生成的气体D为NH3;溶液F通入过量二氧化碳生成沉淀,判断溶液H中含有AlO2-;证明原溶液中一定含有Al3+;沉淀H为Al(OH)3;原溶液中一定含有Al3+、NH4+、Fe2+、SO42-;一定不含Ba2+、CO32-、SiO32-、NO3-;可能含有的Fe3+;用KSCN溶液可检验是否含有Fe3+。
(2)溶液F加入过量的CO2得到的溶液I,一定含有生成的NaHCO3、第①②步剩余和生成的NaNO3和Ba(NO3)2。
(3)①为Ba2+与SO42?反应、NO3?和H+氧化Fe2+;②NaOH与NH4+和Fe3+反应;③为Fe(OH)3与HCl的反应;④为CO2、H2O与AlO2-生成Al(OH)3的反应,所以符合“强酸制弱酸”反应为④。
(4)步骤①中生成气体A为NO3?、H+氧化Fe2+,配平可得离子方程式:)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O 。
本题难度:一般