微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式正确的是
A.Ba(OH)2溶液中滴入足量的NaHCO3溶液:Ba2++OH-+HCO3-=BaCO3↓+H2O
B.Ba(OH)2溶液中滴入CuSO4溶液:2OH-+Cu2+=Cu(OH)2↓
C.盐酸和澄清的石灰水混合:H++OH-=H2O
D.Cu与浓硫酸反应:Cu2++4H++SO42-=Cu2++SO2↑+2H2O
参考答案:C
本题解析:
本题难度:一般
2、选择题 向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中三种离子的物质的量之比为
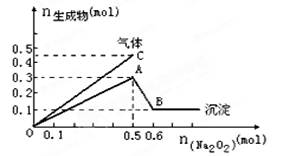
A.2∶1∶2
B.1∶2∶2
C.2∶2∶1
D.9∶2∶4
参考答案:A
本题解析:2Na2O2+2H2O=4NaOH+O2↑? NH4++OH- NH3↑+H2O
NH3↑+H2O
可知,加入的0.5 molNa2O2会产生0.25mol的氧气,而图中共产生0.45mol的气体,所以同时有0.2mol的氨气生成,进而可知原溶液中的NH4+为0.2mol;
图示中由A点到B点,沉淀的物质的量由0.3mol降至0.1mol,可知其中有0.1mol的Mg(OH)2,有0.2mol的Al(OH)3,依据原子守恒可知,原溶液中的Mg2+、Al3+物质的量分别为0.1mol、0.2mol,故原溶液中三种离子的物质的量之比为2∶1∶2,答案为A
本题难度:一般
3、选择题 已知反应M2O7x-+3S2-+14H+=2M3++3S↓+7H2O,则M2O7x-中的M的化合价为?
A.+2
B.+3
C.+4
D.+6
参考答案:D
本题解析:根据电荷守恒可知,x=2,则M的化合价为+6价。答案选D。
点评:此类习题主要根据电荷守恒来判断元素的化合价,难度适中。
本题难度:一般
4、填空题 在稀硫酸酸化的含6 mol KI溶液中逐滴加入KBrO3溶液,整个过程中含碘物质与所加入KBrO3物质的量的关系如图。

请回答下列问题:
(1)b点时,对应含碘物质的化学式为?。
(2)b→c过程中,仅有一种元素发生化合价变化,写出该反应的化学方程式并标出电子转移方向与数目?。
(3)当n(KBrO3)=4mol时,体系中对应含碘物质的化学式为?。
(4)酸性条件下,Br2、IO3-、BrO3-、I2氧化性由强到弱的顺序为?。
(5)在稀硫酸酸化的KBrO3溶液中不断滴入淀粉KI溶液,边滴边振荡。则实验过程中的可能观察到的现象为?。
参考答案:
(1)I2;(1分)
(2)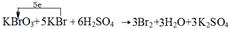 (2分)
(2分)
(3)KIO3和I2(2分)
(4)BrO3- > IO3- > Br2 > I2(1分)。
(5)溶液先无色,后变蓝色,合理给分(2分)。
本题解析:(1)b点时,KI反应完全,有图象可知参加反应的KI为6mol,KBrO3为1mol,则消耗的氧化剂与还原剂物质的量之比为1;6,发生反应为6I-+BrO3-=Br-+3I2,还原产物是KBr,故答案为:1:6;KBr;(2)b→c过程中,仅有一种元素发生化合价变化,应是BrO3-与Br-之间的氧化还原反应,反应的离子方程式为BrO3-+5Br-+6H+=3Br2+3H2O,故答案为:BrO3-+5Br-+6H+=3Br2+3H2O;(3)①反应2BrO3-+I2=2IO3-+Br2中,I2为还原剂,Br2为还原产物,应有还原性I2>Br2,该同学的结论不正确,故答案为:不正确,该反应中I2作还原剂,Br2为还原产物,应得出还原性I2>Br2结论(合理即可);②n(KBrO3)=4时,发生的反应依次有6I-+BrO3-=Br-+3I2,BrO3-+5Br-+6H+=3Br2+3H2O,2BrO3-+I2=2IO3-+Br2,6molKI生成I2,需要1molKBrO3,同时生成1molKBr,发生BrO3-+5Br-+6H+=3Br2+3H2O,需要0.2molKBrO3,如I2完全被氧化生成KIO3,还应需要6molKBrO3,则n(KBrO3)=4时,对应含碘物质的化学式为I2,KIO3,故答案为:I2,KIO3;(4)发生的反应依次有6I-+BrO3-=Br-+3I2,BrO3-+5Br-+6H+=3Br2+3H2O,2BrO3-+I2=2IO3-+Br2,总反应为6I-+6BrO3-=5IO3-+3Br2,则含amolKI的硫酸溶液所能消耗n(KBrO3)的最大值为1.2amol,故答案为:1.2a。
本题难度:一般
5、选择题 下列各组离子在指定溶液中能大量共存的是
A.能使酚酞变红色的溶液:Na+、Cl-、S2-、SO32-
B.无色溶液中:K+、Na+、MnO4-、SO42-
C.滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3-
D.含有0.1 mol/L Fe3+的溶液中:K+、Mg2+、S2-、SO42-
参考答案:A
本题解析:试题分析:离子间如果发生化学反应,则不能大量共存,反之是可以的。A中能使酚酞变红色的溶液显碱性,可以大量共存;B中MnO4-在溶液中显紫红色,不能大量共存;C中滴加甲基橙试剂显红色的溶液显酸性,在酸性条件下NO3-能氧化Fe2+,不能大量共存;D中铁离子能氧化S2-,不能大量共存,答案选A。
考点:考查离子共存的正误判断
点评:该题是高考中的高频题,属于中等难度的试题,侧重对学生基础知识的训练和检验。有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。该题需要明确离子不能大量共存的一般情况,即(1)能发生复分解反应的离子之间;(2)能生成难溶物的离子之间;(3)能发生氧化还原反应的离子之间;(4)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有:(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。
本题难度:简单