微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某有机物链状分子中含a个 —CH3 , b个—CH2— ?, m个  ?, n个C原子,其余为羟基。则该有机物分子中羟基的个数为(?)
?, n个C原子,其余为羟基。则该有机物分子中羟基的个数为(?)
A.2n+3m-a+2
B.n+m+a-b
C.2m+n+2-a
D.m+2n+2-a
参考答案:D
本题解析:若将羟基看做氢原子,则为饱和链烃基,应符合烷烃通式:CnH2n+2,
题中碳原子共有+n个,则氢原子共有2(a+b+m+n)+2个,
题中氢原子数为3a+2b+m个,则羟基个数为[2(a+b+m+n)+2]-( 3a+2b+m)= m+2n+2-a,
故D正确
本题难度:一般
2、选择题 甲烷和丙烷混和气的密度与同温同压下乙烷的密度相同,混和气中甲烷和丙烷的体积比是(? )
A.2:1
B.3:1
C.1:3
D.1:1
参考答案:D
本题解析:因为密度之比是气体的相对分子质量之比,因此甲烷和丙烷的平均相对分子质量是30。根据十字交叉法可知甲烷和丙烷的体积之比是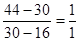 ,所以答案选D。
,所以答案选D。
本题难度:一般
3、选择题 两种气态烃组成的混合气体0.1mol,完全燃烧得0.16molCO2和3.6gH2O,则混合气体中
A.混和气体中一定有甲烷
B.混和气体中一定有甲烷和乙烯
C.混和气体中一定有乙烷
D.混和气体中一定有乙炔
参考答案:A
本题解析:0.1mol混合气体,完全燃烧得0.16molCO2和0.2molH2O,即1个分子中平均占有1.6个C和4个H,则两种气态烃中有一种肯定是甲烷,另一种可能是乙烯或乙炔。
点评:利用平均分子式法可以快速确定分子组成,属于较简单题。
本题难度:一般
4、填空题 (8分)现有A、B两种链状饱和一元醇的混合物0.1 mol,其质量为4.6g。已知①A和B碳原子数均不大于4,且A<B;②A和B分子中均不含有支链,且都能被催化氧化生成醛。
(1)混合物中A可能的分子式?;B可能的分子式?。?
(2)若n(A):n(B)=1:1时, A的名称??;B的名称?。?
(3)若n(A):n(B)≠1:1时,A的结构简式为?;? B的结构简式为?; 则 n(A)∶n(B)= ?。
参考答案:(1)CH4O(1分);C3H8O或C4H10O (2分)?
(2)甲醇(1分);丙醇(1分);
(3)CH3OH(1分);CH3CH2CH2CH2OH(1分);
本题解析:根据一元饱和醇的通式:CnH2n+2O,当相对原子质量为46时,n=2,所以A和B混合后碳原子数平均为2,那么A为1,B为3或者4。(1)A中碳原子为1,所以为甲醇,CH4O,B为丙醇,或者丁醇:C3H8O或C4H10O。(2)当A与B比例为1:1时,B为丙醇。(3)当比例不是1:1时,B为丁醇,根据平均碳原子数位2,可以算出A:B=2:1。
点评:本题属于容易题,抓住解题关键为饱和一元醇通式的计算。
本题难度:一般
5、填空题 乙烷和乙炔混合物共m mol,与n mol的氧气点燃后完全反应,得到CO和CO2的混合气体,以及36g水。试求:
(1)当m=0.8时,乙烷和乙炔的物质的量之比 。
(2)当m=1时,且反应后CO和CO2混合气体的物质的量是反应前氧气的物质的量的5/6时,则n=?,得到的CO和CO2的物质的量之比 。
(3)m的取值范围是 ,n的取值范围是 。
参考答案:(7分)
(1)3:1
(2)2.4 3:2
(3)0.67或(2/3)<m<2 1.67或(5/3)<n<5
本题解析:据元素守恒,反应后混合气体的耗氧量即是C2H2和C2H6的耗氧量,反应生成CO、CO2和H2O,根据碳元素守恒有n(CO2)+ n(CO)=2n(C2H2)+2n(C2H6),根据氢元素守恒由2n(H2O)=2n(C2H2)+6n(C2H6),根据氧元素守恒有2n(O2)=2n(CO2)+ n(CO)+n(H2O),据此计算消耗的氧气。
水的物质的量为36g/18(g/mol)=2mol.
设C2H2为amol,为C2H6bmol。
(1)则根据H守恒得:
2a+6b=4mol? a+b="0.8mol" 解得a=0.2mol? b=0.6mol
乙烷和乙炔的物质的量之比为3:1。
(2)m=1时,a+b=1mol,根据C守恒,(2a+2b)/n="5/6" 解得n=2.4。
根据C守恒得:n(CO)+n(CO2)=2a+2b=2
根据O守恒的:n(CO)+2n(CO2)+2=2.4*2=4.8
解得:n(CO)=6/5,n(CO2)=4/5
即CO和CO2的物质的量之比3:2。
(3)根据H守恒得:
2a+6b=4mol①
a+b=mmol② 即a=m-b③ b=m-a④
把③带入①得:m=2-b,当b>0时,m<2。
把④带入①得:m=2/3+2a/3,当a>0时,m>2/3(或0.67)。
即0.67或(2/3)<m<2。
m值最大时n最大,m值小时n最小,故1.67或(5/3)<n<5。
点评:本题考查混合物的计算,难度中等,判断反应后混合气体的耗氧量即是C2H2和C2H6的耗氧量是关键,在利用元素守恒计算,注意混合计算中守恒思想的运用。
本题难度:一般