微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知BrCl能发生下列反应:nBrCl+2M====MCln+MBrn(M为+n价金属元素),BrCl+H2O====HCl+HBrO;以下推论不正确的是
A.BrCl具有和卤素单质相似的化学性质
B.BrCl和M反应时,BrCl只作氧化剂
C.将BrCl和NaOH溶液反应生成NaCl和NaBrO两种盐
D.将BrCl跟FeSO4溶液反应,溶液会变成无色
参考答案:D
本题解析:根据题给信息知BrCl性质类似卤素单质.A、B、C正确,但D项BrCl跟FeSO4反应会把Fe2+氧化成Fe3+,故不会变成无色.
本题难度:一般
2、选择题 下列试剂保存方法不正确的是(? )
A.AgNO3溶液保存在棕色细口瓶中
B.氢氟酸保存在特制塑料瓶中
C.澄清石灰水保存在带胶塞的无色细口玻璃瓶中
D.AgBr保存在无色试剂瓶中
参考答案:D
本题解析:AgNO3见光分解,应保存在棕色细口瓶中;氢氟酸能腐蚀玻璃,常用特制塑料瓶盛装;Ca(OH)2能与玻璃成分之一的SiO2反应,盛石灰水的玻璃试剂瓶常用胶塞;AgBr见光易分解,不能保存在无色试剂瓶内。
本题难度:简单
3、填空题 某同学应用如图所示装置研究气体的性质.现有某气体,其主要成分是氯气,还含有少量空气和水蒸气.?请回答:
(1)该实验研究的主要目的是______.浓硫酸的作用是______.
(2)B、C中能观察到的实验现象是B中______;C中______.
(3)从物质性质方面来看,这样的实验设计还存在事故隐患,因此还需增加______装置,写出增加的装置中发生反应的离子方程式并标出电子转移的方向和数目______.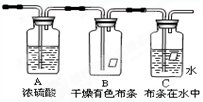
参考答案:(1)本实验为对比实验,将氯气分别作用于干燥布条和湿润布条进行比较,不难看出实验目的是探究氯气具有漂白性的条件,浓硫酸具有吸水性,常用作干燥剂,本试验中起到吸收气体中的水的作用,
故答案为:探究氯气具有漂白性的条件,干燥氯气;
(2)干燥氯气不具有漂白性,所以B中有色布条不能褪色,氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性,所以C中有色布条褪色,故答案为:有色布条不褪色,有色布条褪色;
(3)氯气有毒,应进行尾气处理,不能随意排放到空气中;氯气溶于水呈酸性,所以可以用氢氧化钠溶液处理尾气,反应中转移电子数是1,所以该离子反应方程式为:
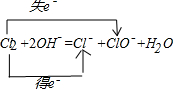
,
故答案为:尾气处理装置,
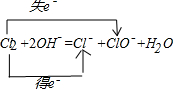
.
本题解析:
本题难度:一般
4、选择题 溴化碘(IBr)的化学性质与卤素单质相似,它和水反应的化学方程式:IBr+H2O?HBr+HIO。则下列关于IBr的叙述中不正确的是()
A.IBr是共价化合物
B.在很多反应中,IBr是强氧化剂
C.IBr与水反应时既是氧化剂又是还原剂
D.IBr与氢氧化钠溶液反应生成NaBr、NaIO和H2O
参考答案:C
本题解析:此题必须抓住IBr化学性质与卤素单质(如Cl2)相似及IBr与水反应的化学方程式这两点提示。要认识到IBr是卤素共价化合物(卤素互化物),不是单质,因此不能把IBr完全与卤素单质等同起来,运用卤素单质的思维定势去解题。
IBr与卤素单质的性质关系具体表现在IBr能像卤素单质一样与水反应:Cl2+H2O HCl+HClO;IBr+H2O
HCl+HClO;IBr+H2O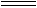 HBr+HIO。
HBr+HIO。
在很多反应中,它们都是强氧化剂:Cl2+2H2O+SO2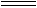 2HCl+H2SO4;IBr+2H2O+SO2
2HCl+H2SO4;IBr+2H2O+SO2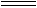 HI+HBr+H2SO4。
HI+HBr+H2SO4。
又由IBr+H2O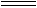 HBr+HIO知:IBr与NaOH作用的产物是NaBr和NaIO。又因为元素的非金属性Br>I,所以IBr分子中原子间的共用电子对偏向Br原子,分子中碘原子显+1价,溴原子显-1价,与跟水反应后产物中溴、碘化合价一致,所以IBr跟水的反应不是氧化还原反应,IBr在此反应中既不是氧化剂又不是还原剂。
HBr+HIO知:IBr与NaOH作用的产物是NaBr和NaIO。又因为元素的非金属性Br>I,所以IBr分子中原子间的共用电子对偏向Br原子,分子中碘原子显+1价,溴原子显-1价,与跟水反应后产物中溴、碘化合价一致,所以IBr跟水的反应不是氧化还原反应,IBr在此反应中既不是氧化剂又不是还原剂。
本题难度:简单
5、实验题 (6分)已知Cl2+H2O  ?HCl+HClO。为了探究HClO的漂白性,某同学设计了如下的实验。
?HCl+HClO。为了探究HClO的漂白性,某同学设计了如下的实验。
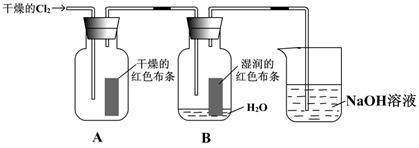
(1)通入Cl2后,从集气瓶A中干燥的红色布条没有褪色的现象可得出的结论是??;
从集气瓶B中湿润的红色布条的现象可得出的结论是??。
(2)为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是??。
参考答案:(6分,每空2分)
⑴干燥的氯气无漂白性;⑵潮湿的氯气具有漂白性;⑶HCl不能使湿润的红色布条褪色
本题解析:(1)干燥的红色布条没有褪色,说明干燥的氯气无漂白性。集气瓶B中湿润的红色布条褪色,说明潮湿的氯气具有漂白性。
(2)由于氯气和水反应还有氯化氢生成,所以还必须增加氯化氢能否使布条褪色的实验。
点评:该题属于基础性试题,难度不大。关键是注意要有对比实验,以增强实验的准确性和严密性。
本题难度:一般