微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述中,正确的是
A.H2SO4的摩尔质量是98
B.等质量的O2和O3中所含的氧原子数相同
C.等质量的CO与CO2中所含碳原子数之比为7:11
D.98g?H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2?mol?L-1
参考答案:B
本题解析:分析:A.摩尔质量的单位是g/mol;
B.氧气和臭氧是同素异形体,其氧原子的摩尔质量相同,根据N= 判断;
判断;
C.每个一氧化碳和二氧化碳分子中碳原子个数相等,再根据N= 判断;
判断;
D.根据C=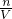 ?判断.
?判断.
解答:A.硫酸的摩尔质量是98g/mol,故A错误;
B.氧气和臭氧是同素异形体,氧原子的摩尔质量相等,用质量比氧原子的摩尔质量即得氧原子的物质的量,氧原子的物质的量相等,所以其原子个数 相等,故B正确;
C.每个一氧化碳和二氧化碳分子中碳原子个数相等,再根据N= 知,等质量的一氧化碳和二氧化碳中其原子个数之比等于其摩尔质量之比的倒数=44:28=11:7,故C错误;
知,等质量的一氧化碳和二氧化碳中其原子个数之比等于其摩尔质量之比的倒数=44:28=11:7,故C错误;
D.C=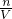 ?中体积指溶液体积而不是溶剂体积,故D错误;
?中体积指溶液体积而不是溶剂体积,故D错误;
故选B.
点评:本题考查了摩尔质量、物质的量的有关计算,易错选项是D,注意配制溶液中V指溶液的体积而不是溶剂的体积,为易错点.
本题难度:简单
2、选择题 含MgCl2、FeCl3、Al2(SO4)3三种溶质的混合溶液中,已知Cl-为1.5mol,Al3+和Fe3+共0.5mol,Mg2+为0.5mol,则SO42-的物质的量为
A.1mol
B.0.5mol
C.0.25mol
D.0.15mol
参考答案:B
本题解析:分析:令硫酸根的物质的量为n,根据溶液中阴阳离子所带的正负电荷总数相等,列式计算n值.据此判断.
解答:令硫酸根的物质的量为n,根据溶液中阴阳离子所带的正负电荷总数相等,则:
0.5mol×3+0.5mol×2=1.5mol×1+2n
解得:n=0.5mol.
故选:B.
点评:考查溶液物质的量浓度的计算,浓度不大,利用常规解法,比较麻烦,本题根据溶液不显电性阳离子与阴离子所带电荷总数相等,即电荷守恒原则解答,注意电荷守恒原则在混合溶液有关离子浓度计算经常运用.
本题难度:困难
3、选择题 下列变化属于物理变化的是
A.乙烯水化
B.苯的硝化
C.塑料老化
D.石油分馏
参考答案:D
本题解析:分析:物理变化是指物质的位置、状态等发生改变,但变化的实质是无新物质生成;化学变化的实质是在原子核不变的情况下,有新物质生成,分析各选项是否符合物理变化的实质.
解答:A.乙烯和水发生了加成反应生成乙醇,发生了化学变化,故A错误;
B.苯和硝酸发生取代反应,生成硝基苯和水,是化学变化,故B错误;
C.塑料在空气中被氧气氧化,发生了化学变化,故C错误;
D.分馏的原理,是利用液体混合物中各成分的沸点不同,进行逐一先汽化后冷却液化,分离成相对纯净物质的过程,只是将原来的物质分离,没有新物质生成,是物理变化.石油就是由沸点不同的汽油、煤油、柴油等混合而成,通过分馏将它们分离,是物理变化,故D正确;
故选D.
点评:本题考查了物理变化的概念,从概念入手,注意物理变化与化学变化的本质区别就是化学变化有新物质生成.
本题难度:简单
4、选择题 若20g密度为dg/cm3的硝酸钙溶液里含有1gCa2+,则NO3-的物质的量浓度为
A.d/400mol/L
B.20/d?mol/L
C.2.5d?mol/L
D.1.25?mol/L
参考答案:C
本题解析:分析:根据V= 计算溶液的体积,根据n=
计算溶液的体积,根据n= 计算1g钙离子的物质的量,溶液中n(NO3-)=2n(Ca2+),再根据c=
计算1g钙离子的物质的量,溶液中n(NO3-)=2n(Ca2+),再根据c=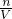 计算NO3-的物质的量浓度.
计算NO3-的物质的量浓度.
解答:1g钙离子的物质的量为 =0.025mol,所以溶液中n(NO3-)=2n(Ca2+)=0.05mol,
=0.025mol,所以溶液中n(NO3-)=2n(Ca2+)=0.05mol,
溶液的体积为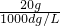 =
=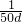 L,
L,
故NO3-的物质的量浓度为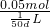 =2.5d?mol/L,
=2.5d?mol/L,
故选C.
点评:本题考查物质的量浓度的有关计算,难度不大,注意对公式的理解及钙离子与硝酸根离子的关系.
本题难度:简单
5、选择题 设NA为阿伏伽德罗常数的数值,则下列说法正确的是
A.1?L?0.5?mol?L-1CH3COOH溶液中,CH3COO-离子的个数为0.5NA
B.标准状况下,22.4?LSO3所含分子数为NA
C.常温下,1L?pH=l的硝酸溶液中含有的H-数为0.1NA
D.一定条件下,1?mol?N2和3?mol?H2合成氨,生成的NH3分子数为2NA
参考答案:C
本题解析:分析:A.醋酸是弱电解质,不能完全电离;
B.标准状况下,SO3是固体;
C.常温下,pH=l的硝酸溶液中c(H+)=0.1mol/L,根据n=cV计算n(H+),再根据N=nNA计算H+数目;
D.N2和H2合成氨属于可逆反应,反应物不能完全转化.
解答:A.醋酸是弱电解质,不能完全电离,1?L?0.5mol?L-1CHCOOH溶液中,CH3COO-离子浓度远小于0.5mol/L,
的个数为0.5NA,故1L该溶液中CH3COO-离子数目原小于0.5NA,故A错误;
B.标准状况下,SO3是固体,不能利用气体摩尔体积计算其物质的量,22.4?LSO3的物质的量远大于1mol,故B错误;
C.常温下,pH=l的硝酸溶液中c(H+)=0.1mol/L,1L该硝酸溶液中n(H+)=0.1mol/L×1L=0.1mol,故H+数目为0.1mol×NAmol-1=0.1NA,故C正确;
D.N2和H2合成氨属于可逆反应,反应物不能完全转化,生成的NH3分子数小于2NA,故D错误;
故选C.
点评:本题考查常用化学计量的有关计算,难度不大,注意B选项中三氧化硫的熔沸点,注意气体摩尔体积的使用条件与对象.
本题难度:困难