微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 根据下表信息,判断以下叙述正确的是(?)
部分短周期元素的原子半径及主要化合价
元素代号
| L
| M
| Q
| R
| T
|
原子半径/nm
| 0.160
| 0.143
| 0.112
| 0.104
| 0.066
|
主要化合价
| +2
| +3
| +2
| +6、—2
| —2
|
A.R与T形成的化合物RT3中,各原子均满足8电子的稳定结构
B.单质与稀盐酸反应产生氢气的剧烈程度为L<Q
C.M与T形成的化合物具有两性
D.L2+与R2-的核外电子数相等
参考答案:C
本题解析:依据原子半径和主要化合价可以得出L、M、Q、R、T五种元素分别为Mg、Al、Be、S、O。R与T形成的化合物SO3中,氧原子满足了8电子稳定结构,而S原子已经超过了8电子,A不正确;Mg和Be均属于第ⅡA族,但活泼性是Mg>Be,B不正确;M与T形成的化合物是Al2O3,Al2O3是你两性氧化物,C正确;.L2+与R2-的核外电子数分别为10和18个电子,D不正确。答案选C。
本题难度:简单
2、选择题 白磷易溶于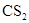 形成溶液,磷元素在该溶液中存在的形式是( )
形成溶液,磷元素在该溶液中存在的形式是( )
A.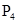 分子
分子
B.磷原子
C.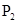 分子
分子
D.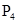 或
或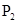 分子
分子
参考答案:A
本题解析:白磷和CS2都是非极性分子,由相似相溶原理可知,所以在该溶液中白磷是以分子的形式存在的,答案选A。B、C、D不正确,白磷以P4分子形式存在。
本题难度:一般
3、选择题 下列电子式书写正确的是
[? ]
A.
B.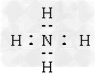
C.
D.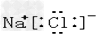
参考答案:D
本题解析:
本题难度:简单
4、选择题 博物馆的陈列室里一般都收藏着许多幅名贵的油画,其中一些美女画由于天长日久而变成了“丑女”,画上白皙动人的肤色也变黑了。这时博物馆的管理员一般都用棉花蘸取双氧水(H2O2)轻轻地在油画上擦拭,以达到重现美女的效果。下列有关双氧水的叙述中不正确的是?
[? ]
A.双氧水中仅含有极性共价键
B.双氧水中既含有极性共价键,又含有非极性共价键
C.双氧水和水中所含氧的化合价不相同
D.双氧水和水的性质不相同
参考答案:A
本题解析:
本题难度:简单
5、填空题 下表是元素周期表的一部分,针对表中的①~⑨种元素,用适当的化学用语填写下列空白:
?族
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族
2
①
②
③
3
④
⑤
⑥
⑦
⑧
4
⑨
|
(1)表中最活泼的金属元素是:______.(填元素符号)
(2)可用于半导体材料的元素是:______(填元素符号),它在元素周期表中的位置为
第______周期______族.
(3)画出元素⑦的原子结构示意图:______,该元素与元素⑨组成的化合物的电子式是:______.
(4)在第3周期元素的最高价氧化物对应水化物中,酸性最强的是:______(填化学式,下同);碱性最强的是:______;具有两性的是______,其与氢氧化钠溶液反应的离子方程式为:______.
参考答案:由元素所在周期表中的位置可知:①为C元素,②为N元素,③为O元素;④为Na元素,⑤为Al元素,⑥为Si元素,⑦为Cl元素,⑧为Ar元素,⑨为K元素,则
(1)根据同周期元素从左到右金属性逐渐减弱,同主族元素从上到下金属性逐渐增强,则在以上元素中,金属性最强的元素为第四周期、ⅠA族元素K,故答案为:K;
(2)金属和非金属分界线的元素常用于半导体材料,在以上元素中,Si常用于半导体材料,原子序数为14,原子核外有3个电子层,最外层电子数为4,则位于第三周期、ⅣA族,故答案为:三、ⅣA;
(3)⑦为Cl元素,原子序数为17,原子核外有3个电子层,最外层电子数为7,则原子结构示意图为
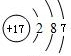
,与K形成的化合物为KCl,为离子化合物,电子式为
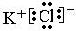
,故答案为:

;
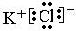
;
(4)根据同周期元素从左到右元素的金属性逐渐减弱,非金属性逐渐增强,则金属性最强的元素为Na元素,其对应的对应最高价氧化物的水化物NaOH的碱性最强,非金属性最强的元素为Cl元素,对应最高价氧化物的水化物HClO4的酸性最强,
Al(OH)3为两性氢氧化物,不溶于水,与氢氧化钠溶液反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O,
故答案为:HClO4;NaOH;Al(OH)3;Al(OH)3+OH-═AlO2-+2H2O.
本题解析:
本题难度:一般