微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 为了除去CO2气体中的SO2气体,下列对于仪器和药品组合中合理的是( )仪器:①洗气瓶 ②干燥管;药品 ③固态生石灰 ④苏打溶液 ⑤小苏打溶液.
A.①⑤
B.②⑤
C.①③
D.①④
参考答案:A
本题解析:
本题难度:简单
2、填空题 我们生产和生活中的很多变化都与氧化还原反应有关。请运用氧化还原反应的知识回答下列问题:
(1)氯气与水反应生成的次氯酸具有杀菌作用,可用于自来水的消毒。在次氯酸中,氯原子容易得到电子,因此次氯酸表现强_________________。
(2)工业上制取漂白粉(用化学方程式表示)_________________________
(3)工业上由SO2制取SO3____________________________
(4)自然界中存在的元素大多以化合态存在,而我们在生产和生活中需要许多单质,如金属铁、单质硅、氧气等。如果要把某元素由化合态变成单质,则它___________________(填序号)
A.被氧化 B.被还原 C.有可能被氧化,也有可能被还原 D.由高价态变为零价
参考答案:(1)氧化性
(2)2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O
(3)2SO2+O2 2SO3?
2SO3?
(4)C
本题解析:
本题难度:一般
3、选择题 下列叙述正确的是( )
A.将SO2通入BaCl2溶液中至饱和,将产生白色沉淀
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解
C.浓HNO3、氯水、AgBr溶液、AgNO3溶液都应该保存在棕色玻璃瓶中
D.工业上分别用电解融熔NaCl、MgCl2、AlCl3的方法制得金属Na、Mg、Al
参考答案:A.SO2通入BaCl2溶液中,假设有沉淀,则会生成盐酸,而盐酸的酸性比亚硫酸的酸性强,盐酸与亚硫酸钡反应生成BaCl2和SO2,故假设不成立,无沉淀生成.故A错误;
B.稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,此时溶液中有Cu(NO3)2电离出的硝酸根离子、稀硫酸电离出的氢离子,铜粉在溶液中相当于与稀硝酸反应.反应的离子方程式为:3Cu+8H++2NO3-=Cu2++2NO↑+4H2O.故B错误;
C.浓HNO3见光分解的方程式为:4HNO3NO3NO3?光照?.?4NO2↑+O2↑+2H2O;
氯水中氯气与水反应:Cl2+H2O?HCl+HClO,生成的次氯酸见光分解的方程式为:2HClO?光照?.?2HCl+O2↑;
AgBr溶液见光分解的方程式为:2AgBrAgBr?光照?.?2Ag+Br2;
AgNO3溶液见光分解的方程式为:2AgNO3AgNO3?光照?.?2Ag+2NO2↑+O2↑所以都应该保存在棕色玻璃瓶中.故C正确;
D.工业上分别用电解融熔NaCl、MgCl2制得金属Na、Mg的方程式分别为:2NaCl?通电?.?2Na+Cl2↑,MgCl2融熔电解?通电?.?Mg+Cl2↑融熔AlCl3只有分子,没有离子,工业上用电解融熔的氧化铝制得铝,反应为:2Al2O3?通电?.冰晶石4Al+3O2↑.故D错误;
故选C.
本题解析:
本题难度:简单
4、选择题 下图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是
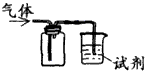
[? ]
试剂?
现象
结论
A.
酸性KMnO4溶液?
溶液褪色
SO2有氧化性
B.
品红溶液?
溶液褪色
SO2有漂白性
C.
NaOH溶液
?无明显现象
SO2与NaOH溶液不反应
D.
紫色石蕊试液?
溶液变红后不褪色
SO2有酸性、没有漂白性
参考答案:B
本题解析:
本题难度:简单
5、填空题 在品红溶液中通入SO2,溶液变为无色,加热后溶液又返回为红色,这是因为H2SO3与品红化合生成_________________;少量Na2O2投入水中,待反应后再滴入品红溶液,红色消失,说明溶液中存在(填化学式______________,其漂白原理与相同_____________。
参考答案:无色不稳定的化合物;H2O2;HClO相同
本题解析:
本题难度:一般