微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 25℃ 时,水的离子积为Kw,该温度下将 a mol ·L-1一元酸 HA 与b mol·L-1一元强碱BOH 等体积混合,若恰好完全反应,下列结论中不正确的是
A. 混合液中:c(H+ ) ≤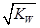 ?B. 混合液中:c(HA)+c(A-)=a mol·L-1?
?B. 混合液中:c(HA)+c(A-)=a mol·L-1?
C.? a = b?D. 混合液中:c(H+)+c(B+)= c(OH-)+c(A-)
参考答案:B
本题解析: HA 与BOH 等体积混合,恰好完全反应:HA+BOH==BA+H2O,酸和碱的物质的量相同,故C正确;根据电荷守恒,D正确;若HA为强酸,反应后的盐溶液为中性,c(H+)=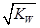 ;若HA为若酸,反应后的盐溶液为碱性,c(H+)<
;若HA为若酸,反应后的盐溶液为碱性,c(H+)<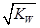 ,A正确;若HA为强酸,反应后的盐溶液为中性,c(A-)=1/2a mol·L-1;若HA为若酸,反应后的盐溶液为碱性,c(HA)+c(A-)=1/2a mol·L-1,B不正确;
,A正确;若HA为强酸,反应后的盐溶液为中性,c(A-)=1/2a mol·L-1;若HA为若酸,反应后的盐溶液为碱性,c(HA)+c(A-)=1/2a mol·L-1,B不正确;
本题难度:一般
2、填空题 25 ℃时,电离平衡常数:
弱酸的化学式
| CH3COOH
| HClO
| H2CO3
|
电离平衡常数(25 ℃)
| 1.8×10-5
| 3.0×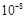
| K1=4.3×10-7
K2=5.6×10-11
|
回答下列问题:
(1)物质的量浓度为0.1 mol/L的下列四种物质:
a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3;
pH由大到小的顺序是 (填编号)。
(2)常温下0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是 ;
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化如图,则HX的电离平衡常数 (填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是 ,
稀释后,HX溶液中水电离出来的c(H+) (填“大于”、“等于”或“小于”)醋酸溶液中水电离出来的c(H+),理由是 ;

(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)= (填准确数值)。
参考答案:(1)a,b,d,c (2)A
(3)大于 稀释相同倍数,HX的pH变化比CH3COOH大,酸性强,电离平衡常数大 大于 HX酸性强于CH3COOH,稀释后c(H+)小于CH3COOH溶液中的c(H+),所以对水的抑制能力减弱 (4)9.9×10-7 mol/L
本题解析:(1)观察电离平衡常数可知酸性为CH3COOH>H2CO3>HClO>HC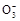 ,而这些酸失去氢离子后水解能力却正好相反,所以得出pH大小顺序为a,b,d,c。
,而这些酸失去氢离子后水解能力却正好相反,所以得出pH大小顺序为a,b,d,c。
(2)醋酸是弱电解质,稀释后电离程度增大,但CH3COOH、CH3COO-、H+浓度却都要减小,但c(OH-)却是增大的,且CH3COOH浓度减少最多,所以A减小,B增大,C不变,D增大。
(3)观察图示稀释100倍pH变化小于两个单位说明HX也为弱酸,pH变化大于醋酸pH变化,因此酸性大于醋酸,电离常数大于醋酸;稀释后c(H+)小于醋酸溶液中的c(H+),所以对水的电离抑制能力减小。
(4)根据电荷守恒得c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6 mol/L-10-8 mol/L=9.9×10-7 mol/L。
本题难度:困难
3、填空题 今有①盐酸、②醋酸、③硫酸三种稀溶液,用序号回答下列问题。
(1)若三种酸的物质的量浓度相等。
a.三种溶液中的c(H+)大小关系为__________________。
b.取等体积上述三种溶液,分别用同浓度的NaOH溶液完全中和,所需NaOH体积大小关系为__________________。
c.若取等质量Zn分别跟这三种溶液反应,使Zn恰好完全反应时,消耗三种酸的体积大小关系为__________________。
(2)若三种酸溶液中的c(H+)相等。
a.三种酸的物质的量浓度大小关系为__________________。
b.取等体积上述三种溶液,分别用同浓度的NaOH溶液完全中和,所需NaOH溶液体积大小关系为
__________。
c.若取等质量Zn分别跟这三种溶液反应,使Zn恰好完全反应时,消耗三种酸的体积大小关系为
__________________。
参考答案:(1)a:③>①>②;b:③>①=②;c:①=②>③
(2)a:②>①>③;b:②>①=③;c:①=③>②
本题解析:
本题难度:一般
4、选择题 在已达到电离平衡的0.1mol-L-1的醋酸溶液中,欲使平衡向电离的方向移动,同时使溶液的pH?降低,应采取的措施是( )
A.加少量水
B.加热
C.加少量盐酸
D.加少量醋酸钠晶体
参考答案:B
本题解析:
本题难度:简单
5、选择题 下列关于电解质溶液的叙述正确的是(? )
A.常温下,在pH=7的醋酸钠和醋酸混合溶液中:c(CH3COO-)>c(Na+)
B.稀释醋酸溶液,溶液中所有离子的浓度均降低
C.在pH=5的氯化钠和稀硝酸的混合溶液中,c(Na+)=c(Cl-)
D.0.1 mol·L-1的硫化钠溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S)
参考答案:C
本题解析:由CH2COONa和CH3COOH混合液中的电荷守恒可知c(CH3COO-)=c(Na+),A错误;稀释醋酸时,c(H+)减小,但c(OH-)增大,B错误;Na2S溶液中存在质子守恒:c(OH-)=c(H+)+c(HS-)+2c(H2S),D错误;NaCl溶液中c(Na+)和c(Cl-)一定相等。
本题难度:一般