微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 为了科学地饮食,了解一些与食品相关的化学知识是必要的。
油炸虾条、薯片等容易挤碎的食品,不宜选用真空袋装,而应采用充气袋装。下列气体中最不应该充入的是(?)
A.氮气
B.二氧化碳
C.空气
D.氧气
参考答案:D
本题解析:食品袋内充氧气,易使食品氧化变质。
本题难度:简单
2、实验题 氨水是一种的常用的化学试剂。
(1)以浓氨水和生石灰为原料,用如下装置为发生装置,可制取少 量氨气。已知:NH3·H2O+CaO=Ca(OH)2+NH3↑。
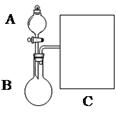
①生石灰应该装在?(填A或B)。
②试从电离平衡角度分析该实验中氨气逸出的原因:?。
③现要用试管和必要实验用品收集一试管氨气,请在C处补充相应收集装置。
(2)化学兴趣小组用氨水与硝酸银溶液配制好银氨溶液后,进行乙醛的银镜反应实验,但部分同学实验时间长,且效果不明显。影响乙醛银镜反应速率的因素有哪些呢?请你完成如下猜想:
①猜想:因素一:银氨溶液的pH大小;
因素二:??。
②你设计实验验证上述影响因素一,完成下表中内容。
提供试剂:乙醛、2%稀氨水、 0.25mol/L NaOH溶液、盐酸 、 2% AgNO3溶液
实验用品:烧杯(装有热水)、试管
实验步骤
| 实验操作
| 预期现象及结论(步骤1只填现象)
|
1
| 在A、B两支洁净的试管中各入1mL 2%的AgNO3溶液,然后边振荡试管边逐滴滴入2%稀氨水,至最初产生的沉淀恰好完全溶解,此时制得pH均约为8的银氨溶液。
| ?
|
2
| ?
| ?
|
?
(3)吸取20.00ml 上述氨水于锥形瓶,滴加3滴甲基橙指示剂,用0.0050mol/L标准硫酸滴定,滴定至出现红色为终点,重复3次实验,平均消耗标准硫酸20.04 ml,计算上述氨水的物质的量浓度??
参考答案:(1)?①B?
②CaO与水反应生成Ca(OH)2,溶液中OH—浓度增大,使NH3+H2O  ?NH4++OH—平衡逆向移动,有利于NH3逸出
?NH4++OH—平衡逆向移动,有利于NH3逸出
③
(2)①反应(水浴)的温度
②
实验步骤
实验操作
预期现象及结论(步骤1只填现象)
1
?
先出现白色沉淀后沉淀溶解
2
往A、B试管加入3滴乙醛,然后在A试管中加多1滴NaOH溶液;振荡后将两支试管放在热水浴中温热。
若A试管比B试管出现的银镜时间短、光亮,则溶液pH大,反应速率快;若A试管比B试管出现的银镜时间长,则溶液pH大,反应速率慢.
?
(3)? 0.01002 mol/L? (每空2分,共16分)
本题解析:(1)①生石灰是固体应装在B圆底烧瓶里,
②氨水中存在NH3+H2O  ?NH4++OH—平衡,加入生石灰,可以与水反应生成Ca(OH)2,溶液中OH—浓度增大,有利于平衡逆向移动,氨气逸出;
?NH4++OH—平衡,加入生石灰,可以与水反应生成Ca(OH)2,溶液中OH—浓度增大,有利于平衡逆向移动,氨气逸出;
③氨气的密度比空气小,用向下排空气法收集,同时在试管口塞一团棉花,防止与空气对流,制取的氨气不纯,装置如图

(2)①影响乙醛银镜反应速率的因素还可能有反应温度的控制;
②银氨溶液的配制过程中会看到先有白色沉淀产生,后沉淀溶解;
验证因素1,可以做对照试验,往A、B试管加入3滴乙醛,然后在A试管中加多1滴NaOH溶液;振荡后将两支试管放在热水浴中温热。比较二者出现银镜的时间,来判断溶液的pH的大小对银镜反应的影响。若A试管比B试管出现的银镜时间短、光亮,则溶液pH大,反应速率快;若A试管比B试管出现的银镜时间长,则溶液pH大,反应速率慢
(3)溶液变红,说明硫酸与一水合氨完全反应生成硫酸铵,根据2NH3·H2O~H2S04,得n(NH3·H2O)=2×20.04×10-3×0.0050mol/L,所以c(NH3·H2O)= n(NH3·H2O)/20.00×10-3L=0.01002 mol/L
本题难度:一般
3、选择题 白磷和红磷在一定条件下可以相互转化,这一变化属于(?)
A.物理变化
B.化学变化
C.氧化还原反应
D.非氧化还原反应
参考答案:BD
本题解析:有新物质生成,但无化合价变化。
本题难度:简单
4、填空题 (14分)
已知铜在常温下能被浓HNO3溶解,反应为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
(1)请将上述反应改写成离子方程式?。
(2)NO2是一种?色的气体,在上述反应中作?(填“氧化”或“还原”)产物,而且是一种能与水反应的气体,其反应的化学方程式为?。
(3)上述反应中氧化剂与还原剂的物质的量之比为?,HNO3在反应中表现出?性和?性。
(4)若反应中生成1mol的NO2,则反应中转移?mol的电子,消耗Cu?g。
参考答案:(1) Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
(2)红棕?还原? 3NO2↑+H2O=2HNO3+NO
(3)2∶1?氧化?酸? (4)1? 32
本题解析:略
本题难度:一般
5、实验题 (15分)亚硝酸钠是一种工业盐,现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。?
已知:①NO+NO2+2OH-=2NO2-+H2O
②气体液化的温度:NO2 21℃、NO -152℃
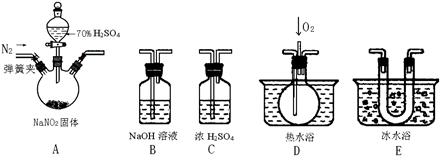
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接):
A 、C、??、??、?。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是:
?。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是?。
②装置E的作用是?。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为?。如果没有装置C,对实验结论造成的影响是??。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是?。
参考答案:(1)E、D、B (3分)
(2)防止可能生成的NO被完全氧化成NO2,造成对A中反应气体产物检验不完全(2分)
(3)①D中出现红棕色气体(2分)②冷凝使NO2完全液化(2分)
(4)4NO2 + O2 + 4NaOH = 4NaNO3 +2 H2O(2分)
水蒸气存在,会与NO2反应产生NO,造成对NO来源于哪里的认识不清(2分)
(5)2NaNO2 + H2SO4 = Na2SO4 + NO2↑ + NO↑+ H2O(2分)
本题解析:(1)由于NO2的液化温度高,所以首先检验NO2,即先通过E,然后再通过D。最后需要有尾气处理,即答案是EDB。
(2)空气中的氧气能氧化NO,所以必须先排尽空气,防止可能生成的NO被完全氧化成NO2,造成对A中反应气体产物检验不完全。
(3)①如果有NO,则经过装置E的冷却后,进入D中的气体,能和氧气反应,生成红棕色气体,即现象是D中出现红棕色气体。
②装置E的作用是冷凝使NO2完全液化。
(4)氧气过量,则进入B装置的气体全部是NO2,所以反应的方程式为4NO2 + O2 + 4NaOH = 4NaNO3 +2 H2O。如果不干燥气体,则水蒸气存在,会与NO2反应产生NO,造成对NO来源于哪里的认识不清。
(5)根据现象可知,亚硝酸钠与硫酸反应生成物既有NO2,还有NO,所以方程式为2NaNO2 + H2SO4 = Na2SO4 + NO2↑ + NO↑+ H2O。
本题难度:一般