微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 ①在含有FeCl3和BaCl2的酸性混合液中,通入足量SO2气体,有白色沉淀生成,过滤后,向滤液中滴加KSCN溶液,不出现红色,②在氨水和BaCl2的混合液中,通入适量SO2气体,也有白色沉淀生成,由此得出的结论是
A.白色沉淀都是BaSO3
B.①白色沉淀是BaSO3和S,②是BaSO3
C.①白色沉淀是BaSO4,②是BaSO3
D.①白色沉淀是FeSO3,②是BaSO3
参考答案:C
本题解析:在①中溶液加入KSCN溶液后不出现血红色,说明SO2气体被Fe3+氧化成SO42-,因此生成的白色沉淀是BaSO4,②中溶液呈碱性,SO2可以跟OH-反应生成SO32-,所以得到的白色沉淀是BaSO3,故C项正确。2的性质、Fe3+的性质和检验。
本题难度:一般
2、计算题 接触法制硫酸是先把SO2催化氧化成SO3,然后用浓硫酸吸收得到的SO3制取产品。某工厂生产硫酸时,进入接触室的原料气成分为SO27%、O2 11%、N2 82%(体积分数)。
(1)计算标准状况下10 m3原料气中的SO2物质的量______________mol。
(2)计算标准状况下1 0m3原料气的质量?千克。
(3)若SO2的转化率为99.2%,计算接触室导出的气体中SO3 的体积分数?。
(4)若接触室导出的气体中含6.72%(体积分数)的SO3。把出口气体送进吸收塔,用
98.3%的硫酸吸收,可得到“发烟H2SO4”(H2SO4和SO3的混合物,其中含质量分数为20%的SO3)。计算吸收1000 m3出口气体(已折算为标准状况)所需要的98.3%的硫酸的质量?千克。
参考答案:(1)31.25(2分)
(2)13.82Kg(4分)
(3)7.19%(4分)
(4)665Kg(6分)
本题解析:(1)原料气中SO2的体积分数为7%,故10m3原料气中的SO2的体积为10m3×7%=0.7m3=700L,故标准状况下二氧化硫的物质的量为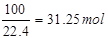 故答案为:31.25;
故答案为:31.25;
(2)原料气中O2的体积分数为11%,故10m3原料气中的O2的体积为10m3×11%=1.1m3=1100L,故标准状况下氧气的物质的量为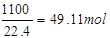 原料气中N2的体积分数为82%,故10m3原料气中的N2的体积为10m3×82%=8.2m3=8200L,故标准状况下氮气的物质的量为
原料气中N2的体积分数为82%,故10m3原料气中的N2的体积为10m3×82%=8.2m3=8200L,故标准状况下氮气的物质的量为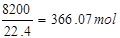 故标准状况下10m3原料气的质量为:31.25mol×64g/mol+49.11mol×32g/mol+366.07mol×28g/mol=13821.48≈13.82kg,答:标准状况下10m3原料气的质量为13.82kg;
故标准状况下10m3原料气的质量为:31.25mol×64g/mol+49.11mol×32g/mol+366.07mol×28g/mol=13821.48≈13.82kg,答:标准状况下10m3原料气的质量为13.82kg;
(3)SO2的转化率为99.2%,则参加反应的二氧化硫的体积为10m3×7%×99.2%=0.6944m3,则:
2SO2+O2=2SO3?体积减少△V
2? 2? 1
0.6944m3?0.6944m3? 0.3472m3
故反应后气体的体积为10m3-0.3472m3=9.6528m3,
故接触室导出的气体中SO3的体积为0.6944m3,体积分数为
答:接触室导出的气体中SO3的体积分数为7.19%;
(4)假设需要浓硫酸的质量为mg,则浓硫酸中硫酸的质量为mg×98g%=0.98mg,物质的量为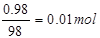 浓硫酸中水的质量为mg-0.98mg=0.02mg,物质的量为
浓硫酸中水的质量为mg-0.98mg=0.02mg,物质的量为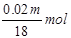 故吸收三氧化硫后生成的硫酸的物质的量为
故吸收三氧化硫后生成的硫酸的物质的量为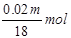 发烟硫酸中硫酸的物质的量为0.01m mol+
发烟硫酸中硫酸的物质的量为0.01m mol+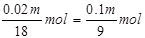 1000m3出口气体中三氧化硫的体积为1000m3×6.72%=67.2m3=67200L,SO3的物质的量为
1000m3出口气体中三氧化硫的体积为1000m3×6.72%=67.2m3=67200L,SO3的物质的量为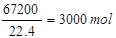 被水吸收后剩余的三氧化硫的物质的量为3000mol-
被水吸收后剩余的三氧化硫的物质的量为3000mol-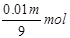
故 ,解得m=664615g=664.6kg,
,解得m=664615g=664.6kg,
答:吸收1000m3出口气体所需要的98%的硫酸的质量为664.6kg.
本题难度:一般
3、选择题 (NH4)2SO4在一定条件下发生如下反应:4(NH4)2SO4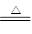 N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,将反应后的混合气体先通过置于冰水浴的U型管,再通入足量的BaCl2溶液,结果为
N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,将反应后的混合气体先通过置于冰水浴的U型管,再通入足量的BaCl2溶液,结果为
A.产生BaSO4和BaSO3沉淀
B.无沉淀产生
C.产生BaSO4沉淀
D.产生BaSO3沉淀
参考答案:D
本题解析:(NH4)2SO4发生分解反应得到的气体中含有N2、NH3、SO2、SO3、H2O在通过置于冰水浴的U型管时,在U型管内会发生反应得到SO3+H2O+ 2NH3 =(NH4)2SO4逸出的气体为SO2、NH3,所以再通入足量的BaCl2溶液时发生反应:NH3+H2O= NH3·H2O;SO2+H2O= H2SO3;2NH3·H2O+ H2SO3= (NH4)2SO3 + 2H2O;(NH4)2SO3+BaCl2= BaSO3↓+ 2NH4Cl。因此最后得到的沉淀为BaSO3。选项为D。4)2SO4分解产物经冰水浴处理后通入BaCl2溶液的沉淀的成分的确定的知识。
本题难度:一般
4、实验题 (12分)
Ⅰ.(3分)化学反应经常伴随着颜色变化,下列有关反应显示的颜色正确的有
①氢氧化亚铁在空气中最终变为灰绿色;?②淀粉溶液遇碘化钾变为蓝色;
③向硫酸铁溶液中加入KSCN变为红色?④品红溶液通入过量氯气后褪色
⑤无水硫酸铜吸收水蒸气变成浅绿色;?⑥新制氯水久置后变为无色;
Ⅱ.(9分)某化学实验小组同学为了证明、比较SO2和氯水的漂白性,设计了如下图所示的实验装置。

(1) 实验室常选用制CO2的发生装置制SO2;实验室在用MnO2跟浓盐酸反应制备Cl2时,应选用上图A、E两发生装置中??装置(填装置序号)制Cl2。在制Cl2的反应中MnO2表现出的性质是?。
(2) 反应开始后,发现B、D两个试管中的品红溶液都褪去,停止通气后,给B、D两个
试管加热,两个试管中的现象分别为B:?,D:?。
(3) 装置C的作用是?。
(4) 甲乙两同学分别利用下图所示装置探究两种气体按不同比例混合后的漂白性。试分析:
①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是:?。

②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是:?,并写出其相应的离子方程式:?。
③乙同学在实验过程中发现:通气一段时间后,品红溶液颜色随时间推移变得越来越浅,其原因是:?。
参考答案:

本题解析:略
本题难度:一般
5、填空题 酸雨主要是燃烧含硫燃料时释放出的二氧化硫造成的。现将每隔一定时间测定某份雨水的pH记录入表所示。
不同时间测得的pH
测试时间/h
| 0
| 1
| 2
| 3
| 4
| …
| 8
|
雨水的pH
| 4.73
| 4.62
| 4.56
| 4.55
| 4.55
| …
| 4.55
|
请说明在测定的时间里,雨水样品的pH变化的原因。
参考答案:雨水呈酸性,是由于二氧化硫溶于水而引起的:SO2 + H2O ="=" H2SO3 ,H2SO3具有还原性,能与空气中的O2发生反应:2H2SO3 + O2 ="=" 2H2SO4,H2SO4的酸性比H2SO3强,所以雨水的pH会逐渐变小。
本题解析:分析表中数据可知,雨水的pH在测定得4h以前逐渐变小,而4h以后不再变化。雨水呈酸性,是由于二氧化硫溶于水而引起的:SO2 + H2O ="=" H2SO3 ,H2SO3具有还原性,能与空气中的O2发生反应:2H2SO3 + O2 ="=" 2H2SO4,H2SO4的酸性比H2SO3强,所以雨水的pH会逐渐变小,直至H2SO3全部被氧化为H2SO4时,pH变得最小,且不再变化。
本题难度:简单