|
|
|
高考化学试题《盐类水解的原理》试题预测(2017年最新版)(三)
2017-09-25 19:15:42
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知:95℃时,KW=1.0×10-12.在该温度下,测得0.1mol·L-1Na2A溶液pH=6,则下列说法正确的是
A.H2A在水溶液中的电离方程式为:H2A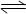 H++HA-,HA- H++HA-,HA-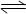 H++A2- H++A2-
B.(NH4)2A溶液中存在离子浓度关系:c(NH4+)>c(A2-)>c(H+)>c(OH-)
C.0.0lmol·L-l的H2A溶液pH=2
D.等体积等浓度的盐酸与H2A溶液分别与5.6g Zn反应,H2A溶液产生的H2多
|
2、选择题 在0.1mol·L-1的NaHCO3溶液中,下列关系式正确的是
A.c(Na+)=c(H2CO3) + c(HCO3-)+ c(CO32-)
B.c(Na+)> c(CO32-> c(HCO3-)> c(OH-)
C.c(Na+)+c(H+)= c(OH-)+ c(HCO3-)+2 c(CO32-)
D.c(HCO3-)+ c(CO32-)="0.1" mol·L-1
|
3、填空题 (16分)常温下,将某可溶性一元碱XOH和HCl溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号
| XOH物质的量浓度(mol·L-1)
| HCl物质的量浓度(mol·L-1)
| 混合溶液的pH
|
甲
| 0.2
| 0.2
| pH=a
|
乙
| c
| 0.2
| pH=7
|
丙
| 0.2
| 0.1
| pH<7
|
丁
| 0.1
| 0.1
| pH=5
|
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明XOH是强碱还是弱碱_________________________________________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2________
(选填“是”或“否”)。混合液中离子浓度c(Cl-)与 c(X+)的大小关系是________________________。
(3)丙组实验结果分析,XOH是________碱(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________________________________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol·L-1。写出该混合溶液中下列算式的精确结果(不能做近似计算)。
c(Cl-)-c(X+)=________mol·L-1 c(H+)-c(XOH)=________mol·L-1
4、选择题 在等物质的量浓度的两种弱酸的钠盐(NaR、NaR′)溶液中分别通入适量的CO2,发生如下反应:NaR+CO2+H2O=HR+NaHCO3,2NaR′+CO2+H2O="2HR′+" Na2CO3。现有物质的量浓度相同的四种溶液:①HR②HR′③NaR④NaR′,由水电离出c(OH-)大小顺序是
A.①>②>③>④
B.②>①>④>③
C.③>④>①>②
D.④>③>②>①
5、实验题 (12分)硫铁矿烧渣的主要成分为Fe2O3、Fe3O4,以及少量SiO2、Al2O3等。由硫铁矿烧渣制备铁红(Fe2O3)的一种工艺流程如下:

已知:还原焙烧时,大部分Fe2O3、Fe3O4转化为FeO。
几种离子开始沉淀和完全沉淀时的pH如下表所示:
离子
| 开始沉淀时的pH
| 完全沉淀时的pH
|
Fe2+
| 7.6
| 9.7
|
Fe3+
| 2.7
| 3.7
|
Al3+
| 3.8
| 4.7
|
(1)“酸浸、过滤”步骤中所得滤液中的金属阳离子有(填离子符号)
。
(2)Fe粉除调pH外,另一个作用是
;Fe粉调节溶液的pH为
。
(3)“沉淀、过滤”步骤中生成FeCO3的离子方程式为
;
所得滤液的主要溶质是(填化学式)
。
(4)高温条件下,“氧化”步骤中发生反应的化学方程式为
。
