微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 氯化溴(BrCl)和Br2、Cl2具有相似的性质,下列有关氯化溴性质的判断中错误的是
A.在CCl4中的溶解性BrCl<Br2?
B.BrCl氧化性比Br2强,比Cl2弱?
C.沸点BrCl>Br2?
D.常温下BrCl可与NaOH溶液反应生成NaCl和NaBrO
参考答案:C?
本题解析:BrCl中Br元素为+1价,BrCl的性质应介于Cl2与Br2之间。
本题难度:一般
2、选择题 下列说法正确的是
①Cl2的化学性质活泼,它与H2混合后立即发生爆炸;
②实验室制取Cl2时,为了防止环境污染,多余的氯气可以用澄清石灰水吸收;
③新制氯水的氧化性强于久置氯水;
④检验HCl气体中是否混有Cl2的方法是将气体通入AgNO3溶液;
⑤除去HCl气体中的Cl2,可将气体通入饱和食盐水。
A.③
B.③⑤
C.①②③
D.②③④
参考答案:A
本题解析::氢气与氯气混合不反应,光照发生爆炸,①错误;吸收氯气不用澄清石灰水,因氢氧化钙微溶,吸收不充分,一般用氢氧化钠溶液,②错误;氯水久置,HClO分解,久置氯水相当于盐酸,③正确;氯气溶于水生成盐酸和HClO,氯化氢溶于水也生成盐酸,所以不可以用硝酸银溶液检验HCl气体中是否混有氯气,可用湿润的淀粉KI试纸检验,④错误;氯气在饱和食盐水中溶解度很小,不可以用饱和食盐水除去氯气,可用活性炭除去,⑤错误。
点评:氯水中存在平衡:Cl2+H2O H++Cl-+HClO,饱和食盐水中c(Cl-)大,抑制氯气溶解。
H++Cl-+HClO,饱和食盐水中c(Cl-)大,抑制氯气溶解。
本题难度:一般
3、填空题 已知氧化性BrO-3>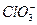 >Cl2>
>Cl2>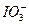 >I2。现将饱和氯水逐滴滴入KI淀粉溶液中至过量。
>I2。现将饱和氯水逐滴滴入KI淀粉溶液中至过量。
(1)可观察到的现象是:
①_____________________________________________________________________________,
②_____________________________________________________________________________。
(2)写出有关的离子方程式:
①____________________________,②____________________________。
参考答案:(1)①溶液先呈现蓝色?②随饱和氯水继续滴入蓝色消失,溶液又呈无色
(2)①Cl2+2I-====2Cl-+I2
②5Cl2+I2+6H2O====12H++2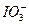 +10Cl-
+10Cl-
本题解析:根据粒子的氧化性强弱顺序:Cl2>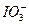 >I2,可推知下列未知反应可以进行:
>I2,可推知下列未知反应可以进行:
5Cl2+I2+6H2O====2HIO3+10HCl(Cl2过量时)。
本题难度:简单
4、填空题 (8分) 实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2 + 4HCl(浓) ?△??MnCl2 + Cl2↑+ 2H2O
(1)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是?mol,转移电子的物质的量是?mol。
(2)在制取Cl2时为防止其污染环境用NaOH溶液吸收尾气.写出其离子方程式___________.
(3)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)?。
参考答案:(1)2 ;2? (2分)?(2)Cl2+2OH- =Cl-+ClO-+H2O (3分)
(3)Cl-+ClO-+2H+=Cl2↑+H2O? (3分)
本题解析:(1)根据反应式可判断每生成1mol氯气,被氧化的氯化氢是2mol,氯原子的化合价从-价升高到0价,所以转移电子的物质的量是2mol。
(2)氯气有毒,需要用氢氧化钠吸收,反应式为Cl2+2OH- =Cl-+ClO-+H2O。
(3)处理设备具有氧化性,能把氯化氢氧化生成氯气,方程式为Cl-+ClO-+2H+=Cl2↑+H2O。
本题难度:一般
5、选择题 下列化合物中,既能通过单质间化合直接制取,也能通过单质和盐酸反应直接制取的是
A.CuCl2
B.FeCl2
C.FeCl3
D.MgCl2
参考答案:D
本题解析:略
本题难度:一般