微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如下图所示,实验桌上放置的两容器中有等体积的甲、乙两种液体。几天后,两者的体积都明显减少,且甲比乙减少得多。由此现象得出的正确结论是?
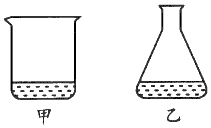
[? ]
A.甲比乙易挥发
B.甲的沸点比乙高
C.甲的熔点比乙低
D.甲与乙都易挥发
参考答案:D
本题解析:
本题难度:简单
2、选择题 偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力。下列叙述正确的是
A.偏二甲肼(C2H8N2)的摩尔质量为60g/mol
B.6.02×1023个偏二甲肼(C2H8N2)分子的质量与其摩尔质量相等
C.1 mol 偏二甲肼(C2H8N2)中共含有12 mol原子
D.6g偏二甲肼(C2H8N2)含有NA个偏二甲肼(C2H8N2)分子
参考答案:AC
本题解析:试题分析:A.偏二甲肼(C2H8N2)的摩尔质量为60g/mol?正确;B.6.02×1023个偏二甲肼(C2H8N2)分子的质量与其摩尔质量相等,错误,在数值上相等,后者有单位,前者没有;C.1 mol 偏二甲肼(C2H8N2)中共含有12 mol原子?正确;D.6g偏二甲肼(C2H8N2)含有0.1NA个偏二甲肼(C2H8N2)分子,故选AC。
考点:物质的量的计算
点评:本题考查有关物质的量的计算,学生需要注意的是只有明确n= m/M,N=n×NA等计算公式是解答本题的关键。
本题难度:一般
3、实验题 (6分)某学生设计了如下实验:

回答下列问题
(1)该同学的实验目的是?;
(2)上图括号内的操作步骤均为?;
(3)按此实验方案得到的NaCl固体中肯定含有?(填化学式)杂质;为了解决这个问题可以向过滤得到的滤液中加入适量的?;
(4)写出生成B的离子方程式:?
参考答案:(1)分离CaCl2和NaCl两种固体混合物
(2)蒸发
(3)Na2CO3?稀盐酸
(4)Ca2++CO32-=CaCO3↓
本题解析:略
本题难度:简单
4、选择题 可以将六种无色液体:C2H5OH、AgNO3溶液,C2H5Br、KI溶液,C6H5OH溶液,C6H6一一区分开的试剂是
A.HCl溶液
B.溴水
C.酸性KMnO4溶液
D.NaOH溶液
参考答案:B
本题解析:略
本题难度:一般
5、实验题 硫代硫酸钠(Na2S2O3)俗称保险粉,可用作定影剂,也可用于纸浆漂白、脱氯剂等。
Na2S2O3易溶于水,不溶于乙醇,常温下溶液中析出晶体通常为Na2S2O·5H2O。实验室制备保险粉的装置如下图所示。涉及的总化学方程式如下: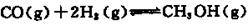

(1)检查虚线框内装置气密性的方法是??。
(2)反应前仪器a中加入的药品为?,仪器c中加入的药品为 ??。
(3)仪器b的名称是?。
(4)在制备过程中,持续通人气体时,观察到B装置中先有大量浅黄色沉淀析出,反应一段时间,沉淀逐渐减少;待浅黄色沉淀消失时反应完成,停止加热。反应的离子方程式为??。
(5)反应完成后,为了从混合溶液中获取产品,操作如下:
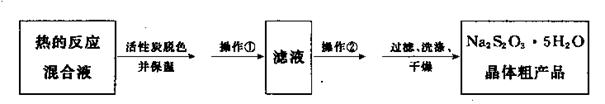
操作②为?。
(6)为了测产品的纯度,称取8.000 g粗产品,配制成250 mL溶液,用移液管移取25.00 mL于锥形瓶中,再用0.05000 mol·L-l的碘标准溶液进行滴定(2S2O32-+I2=S4O62-+2I-),
平行3次实验,平均消耗碘标准溶液的体积为30.00mL。
①测得产品的纯度为?。
②关于上述实验的有关操作,以下表述正确的是 ?。(填编号)
A.用碱式滴定管盛装碘标准溶液
B.用移液管移取25.00mL溶液于锥形瓶中,移液管的尖嘴和锥形瓶内壁要接触
C.如果滴定终点没有控制好,碘标准溶液滴加过量,则必须重新进行滴定
D.滴定过程中若剧烈摇动锥形瓶(溶液不外溅),则所测得的纯度将会偏高
参考答案:(1)关闭蒸馏烧瓶右端活塞,往分液漏斗中加水,打开分液漏斗的活塞,水开始下滴,一段时间后,如果水不再下滴,表明气密性良好。反之则气密性不好。
(2)Na2SO3固体 NaOH溶液(或KMnO4溶液等)
(3)三颈烧瓶
(4)S2O32-+SO2+H2O=S↓+2HSO32-
(5)蒸发浓缩、冷却结晶
(6)①93.00% ②B
本题解析:(1)检查虚线框内装置气密性的方法是关闭蒸馏烧瓶右端活塞,往分液漏斗中加水,打开分液漏斗的活塞,水开始下滴,一段时间后,如果水不再下滴,表明气密性良好。反之则气密性不好。(2)装置A是制取SO2的,反应前仪器a中加入的药品为Na2SO3固体,在分液漏斗内加入稀盐酸或稀硫酸。分数反应为:Na2SO3+H2SO4= Na2SO4+SO2↑+H2O;在装置B中加入Na2S。发生反应2Na2S+3SO2=2Na2SO3+3S ;Na2SO3+S=Na2S2O3。由于SO2或H2S都是大气污染物,所以未完全转化为Na2S2O3的SO2或H2S在装置C中被吸收。SO2或H2S都是酸性气体,同时也有还原性,所以仪器c中加入的药品为NaOH溶液(或KMnO4溶液等) 。(3)仪器b的名称是三颈烧瓶。(4)根据题意可得该反应的离子方程式为S2O32-+SO2+H2O=S↓+2HSO32-。(5)操作②从溶液中结晶析出晶体的操作是蒸发浓缩、冷却结晶。(6) ①由方程式2S2O32-+I2=S4O62-+2I-。可得n(Na2S2O3)=2n(I2)= 2×(0.05000 mol/L×0.03L)×(250 mL÷25.00 mL)=0.03mol.所以测得产品的纯度为(0.03mol×248g/mol)÷8.000g×100%="93.00%." ②A.碘单质有强的氧化性,容易腐蚀橡胶管,所以用酸式滴定管盛装碘标准溶液。错误。B.用移液管移取25.00mL溶液于锥形瓶中时,悬于移液管的尖嘴的液体是在量取体积范围内的,所以要和锥形瓶内壁要接触,使其滴入锥形瓶中。正确。C.测定样品的纯度就是以碘标准溶液为标准的,如果滴定终点没有控制好,碘标准溶液滴加过量,则可通过反滴加待测溶液。根据反应时二者的体积关系进行纯度的计算没有必须重新进行滴定。错误。D.滴定过程中若剧烈摇动锥形瓶,只要溶液不外溅,则二者就可以充分进行反应。所以对所测得的纯度无影响。错误。选项为B。
本题难度:一般