微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (10分)(1)用一种试剂除去下列各物质中的杂质(括号中的物质),写出所用试剂及离子方程式。
①BaCl2(HCl):试剂________,离子方程式____________________________。
②HCl(BaCl2):试剂________,离子方程式____________________________。
(2)把Fe、Cu、FeCl3溶液、FeCl2溶液、CuCl2溶液混合于某容器中充分反应,试判断下列情况下溶液中存在的离子和金属单质。
①若Fe粉有剩余,容器中不可能有________。
②若CuCl2有剩余,容器中还可能有________。
③若FeCl3和CuCl2均有剩余,容器中不可能有________,可能有________。
④若FeCl3有剩余,则容器中不可能有________。
参考答案:?(1)①BaCO3或Ba(OH)2 BaCO3+2H+===Ba2++CO2↑+H2O或OH-+H+===H2O
②H2SO4 Ba2++SO===BaSO4↓
(2)①Fe3+、Cu2+
②Fe2+、Fe3+或Cu、Fe2+
③Fe、Cu Fe2+
④Fe、Cu
本题解析:(1)除去BaCl2中的HCl,其实质是除去H+,可用BaCO3或Ba(OH)2;除去HCl中BaCl2,其实质是除去Ba2+,可用H2SO4。除杂质时不能引进其他杂质,除杂试剂要适量。
(2)根据反应原理:Fe+2FeCl3===3FeCl2,Fe+CuCl2===Cu+FeCl2,Cu+2FeCl3===2FeCl2+CuCl2.弄清发生的反应,明确还原性顺序,即Fe>Cu>Fe2+>Fe3+,凡是能发生反应的物质就不能共存。
本题难度:一般
2、选择题 下列每组各有三种物质,它们都能用分液漏斗分离的是 (? )
A.乙酸乙酯和水,酒精和水,苯酚和水;
B.二溴乙烷和水、溴苯和水、硝基苯和苯
C.甘油和水、乙醛和水、乙酸和乙醇;
D.油酸和水,甲苯和水,已烷和水
参考答案:D
本题解析:可以用分液漏斗分离,这说明两种液态物质是互不相溶的,A中的酒精和水互溶,B中的硝基苯易溶在苯中,C中的物质都是互溶或易溶的,所以正确的答案选D。
点评:该题是基础性试题的考查,难度不大。该题的关键是明确分液的原理,以及常见物质的溶解性,然后结合题意灵活运用即可,有利于培养学生规范严谨的实验设计能力,提升学生的学科素养。
本题难度:一般
3、选择题 下列有关实验原理或操作正确的是(?)
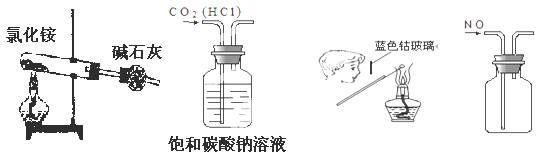
A.实验室制NH3
B.除去CO2中的HCl
C.检验K2CO3中的K+
D.收集NO
参考答案:C
本题解析:A、氯化铵分解产生氨气和氯化氢,遇冷又结合生成氯化铵,错误;B、二氧化碳也与碳酸钠溶液反应,错误;C、检验钾元素的存在,用焰色反应,需透过蓝色钴玻璃观察火焰的颜色,正确;D、一氧化氮与空气中的氧气反应生成二氧化氮,所以不能用排空气法收集一氧化氮,错误,答案选C。
本题难度:一般
4、选择题 除去下列括号内杂质的试剂或方法错误的是
[? ]
A.HNO3溶液(H2SO4),适量BaCl2溶液,过滤
B.CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气
C.KNO3晶体(NaCl),蒸馏水,结晶
D.C2H5OH(CH3COOH),加足量CaO,蒸馏
参考答案:D
本题解析:
本题难度:一般
5、实验题 某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀。甲同学认为沉淀是CuCO3;乙同学认为沉淀是CuCO3和Cu(OH)2的混合物,他们设计实验测定沉淀中CuCO3的质量分数。
(1)按照甲同学的观点,发生反应的离子方程式为?。
(2)两同学利用下图所示装置进行测定:
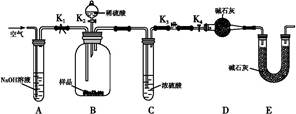
①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为过滤、洗涤、干燥。
②装置E中碱石灰的作用是?。?
③实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是?(填选项序号,下同)。若未进行步骤?,将使测量结果偏低。?
④若沉淀样品质量为m g,装置D质量增加了n g,则沉淀中CuCO3的质量分数为?。?
(3)丙同学认为还可以通过测量CO2的体积并测量?来测定沉淀中CuCO3的质量分数。?
参考答案:(1)Cu2+ + 2HC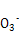 =uCO3↓+ CO2↑+ H2O
=uCO3↓+ CO2↑+ H2O
(2)②防止空气中CO2和水蒸气进入装置D?③ cab? b
④ ×100%
×100%
(3)样品质量(或样品充分灼烧后的质量)(其他合理答案也可)
本题解析:(1)如果甲的观点正确,则生成碳酸铜的同时,必然还生成CO2和水,离子方程式为Cu2+ + 2HC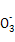
 CuCO3↓+CO2↑+ H2O。
CuCO3↓+CO2↑+ H2O。
(2)②由于空气中也含有水蒸气和CO2,所以E中碱石灰的作用是防止空气中的CO2和水蒸气进入装置D,干扰实验结果。
③由于装置中也含有空气,所以首先要排尽装置中的空气,然后再反应。由于反应中生成的气体会残留在装置中,因此反应结束后,再通入空气将反应生成的气体全部排出,因此正确的答案选cab。如果不进行b步骤,必使CO2的量偏小,将使测量结果偏低。
④D是吸收CO2的,所以碳酸铜的质量是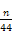 ×124 g,所以碳酸铜的质量分数是
×124 g,所以碳酸铜的质量分数是 ×100%。
×100%。
(3)由CO2的体积可计算CuCO3的物质的量,还必须直接或间接测得样品的质量。
本题难度:一般