微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氨是一种重要的化工原料,氨的合成与应用是当今重要研究内容之一。不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2起始物质的量之比为1∶3)。
 压强(Mpa) 压强(Mpa)
 氨的平 氨的平
衡含量(%)
温度(℃)
| 0.1
| 10
| 20
| 30
| 60
| 100
|
200
| 15.3
| 81.5
| 86.4
| 89.9
| 9 5.4 5.4
| 98.8
|
300
| 2.2
| 52.0
| 64.2
| 71.0
| 84.2
| 92.6
|
400
| 0.4
| 25.1
| 38.2
| 47.0
| 65.2
| 79.8
|
500
| 0.1
| 10.6
| 19.1
| 26.4
| 42.2
| 57.5
|
600
| 0.05
| 4.5
| 9.1
| 13.8
| 23.1
| 31.4
|
回答下列有关问题:
(1)利用表中数据推断得出合成氨的反应是__________反应(填“放热”、“吸热”或“无热量变化”)。
(2)根据表中数据,在200℃和100MPa时,平衡体系中NH3的物质的量分数最高,而实际工业生产不选用该条件的主要原因是___________________________________。
(3)一定条件下,对在密闭容器中进行的合成氨反应达平衡后,其他条件不变时,若同时压缩容器的体积和升高温度达新平衡后,与原平衡相比,请将有关物理量的变化的情况填入下表中(填“增大”、“减小”或“可能增大也可能减小”):
(4)将1molH2和1molN2通入一体积不变的密闭容器中,在一定温度和催化剂作用下,反应达到平衡,测得NH3的物质的量为0.3mol,此时若移走0.5molH2和0.5molN2,则反应达到新的平衡时,NH3的物质的量为_____________(选填答案编号)。
A.0.3mol
B.0.15mol
C.小于0.15mol
D.大于0.15mol,小于0.3mol
2、选择题 化学与环境保护密切相关。下列叙述中正确的是
[? ]
A.处理废水时加入明矾可作为消毒剂以除去水中的杂质
B.垃圾是放错地方的资源,应分类回收利用
C.绿色化学的核心是应用化学原理对环境污染进行治理
D.为提高农作物的产量和质量,应大量使用化肥和农药
3、填空题 (12分) 氮化硅硬度大、熔点高、不溶于酸(氢氟酸除外),是一种重要的结构陶瓷材料。一种用工业硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1420℃,高温下氧气及水蒸气能明显腐蚀氮化硅。一种合成氮化硅的工艺主要流程如下:
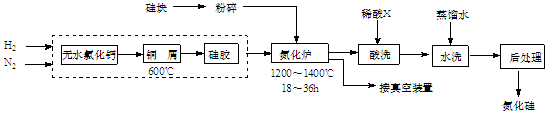
(1)净化N2和H2时,铜屑的作用是:?;硅胶的作用是?。
(2)在氮化炉中3SiO2(s)+2N2(g)=Si3N4(s) △H=-727.5kJ/mol,开始时为什么要严格控制氮气的流速以控制温度:?;体系中要通入适量的氢气是为了?。
(3)X可能是?(选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”)。
(4)用硅粉作硅源、叠氮化钠(NaN3)作氮源,直接燃烧生成氮化硅(发生置换反应),该反应的化学方程式为:?。
4、选择题 下列变化中,属于物理变化的是(? )
①石油的分馏 ②煤的干馏?③石油的裂化 ④铝热反应⑤由乙烯变为聚乙烯
⑥氧气转变为臭氧⑦乙烯催熟果实 ⑧苯遇溴水?⑨海水蒸馏法制取淡水
A.①②③④
B.①②⑤⑦
C.①⑧⑨
D.①②⑥⑨
5、填空题 我国是氧化铝生产大国,工业上每生产1 t氧化铝将排出1~2 t赤泥,赤泥大量堆积会对环境造成严重污染。赤泥中主要成分及含量:CaO约占46%、SiO2约占22%、Al2O3约占7%、Fe2O3约占11%、TiO2约占5%及少量其他物质。
⑴一种利用废弃赤泥的方法是将赤泥配成一定的液固比,作为一种吸收剂,吸收热电厂排放的含SO2的烟气,写出吸收SO2时可能发生的化学反应方程式? ▲?。
⑵为综合利用赤泥中的各种成分,某科研小组设计了如下工艺流程:
?
已知:TiO2不溶于稀盐酸、稀硫酸,能溶于浓硫酸生成TiOSO4(硫酸氧钛,易水解)。
①氧化物D的化学式是? ▲?,原料A最好是下列物质中的? ▲?。
A.氨水
B.氢氧化钠
C.生石灰
D.双氧水