微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 当下列反应达到平衡时保持温度和压强不变,向容器中通入氩气,则化学平衡一定不移动的是( )
A.PCl5(g)?PC l3(g)+Cl2(g)
B.N2+3H2?2NH3
C.2HI(g)?H2(g)+I2(g)
D.C2H4+H2?C2H6
参考答案:当反应达到平衡时,保持温度和压强不变,向容器中通入氩气,导致容器的体积增大,则参加反应的各气体的压强减小,
A.该反应是一个反应前后气体体积增大的可逆反应,减小压强,平衡向正反应方向移动,故A不选;
B.该反应是一个反应前后气体体积减小的可逆反应,减小压强,平衡向逆反应方向移动,故B不选;
C.该反应是一个反应前后气体体积不变的可逆反应,减小压强,平衡不移动,故C选;
D.该反应是一个反应前后气体体积减小的可逆反应,减小压强,平衡向逆反应方向移动,故D不选;
故选B.
本题解析:
本题难度:一般
2、简答题 利用天然气合成氨的工艺流程示意图如图1所示:
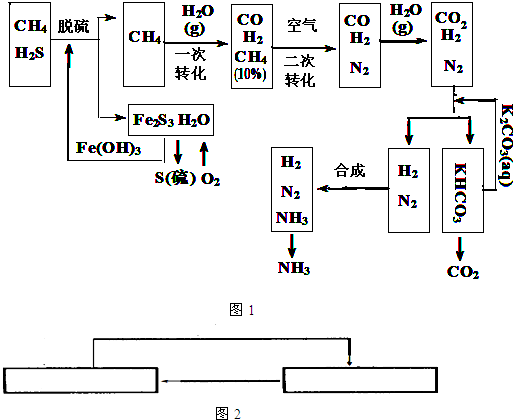
依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是______.
(2)K2CO3(aq)和CO2反应在加压下进行,加压的理论依据是______(多选扣分).
(a)相似相溶原理?(b)勒沙特列原理?(c)酸碱中和原理
(3)由KHCO3分解得到的CO2可以用于______(写出CO2的一种重要用途).
(4)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在图2中标出上述流程图第三处循环(循环方向、循环物质).
(5)在一定温度和压强的密闭合成反应器中,H2和N2混合气体平均相对分子质量为8.5,当该反应达到平衡时,测出平衡混合气的平均式量为10,请计算此时H2的转化率(写出计算过程):______.
参考答案:(1)硫化氢是酸性气体,可以和碱氢氧化铁发生中和反应:3H2S+2Fe(OH)3→Fe2S3+6H2O,
故答案为:3H2S+2Fe(OH)3═Fe2S3+6H2O;
?(2)K2CO3(aq)和CO2反应生成碳酸氢钾,增大压强,化学平衡向右进行,符合化学平衡移动原理,故答案为:b;
(3)二氧化碳可以和氢氧化钠反应生碳酸钠,固体二氧化碳干冰易升华可以做制冷剂,故答案为:生产纯碱(或作制冷剂等);
(4)上述流程图第三处循环使用的物质是氮气和氢气,即

,故答案为:

;
(5)设充入气体总量为1mol,氮气为x,则氢气为(1-x).
则有:28x+2(1-x)=8.5解得:N2:x=0.25mol?H2:1mol-0.25mol=0.75mol
又设平衡时N2转化y,则:
?N2 +3H2?2NH3
起始?0.25mol? ?0.75mol? ?0
变化?y? ?3y? ?2y
平衡?(0.25-y)mol?(0.75-3y)mol?2ymol
则有:28×(0.25-y)mol+2×(0.75-3y)mol+17×2ymol(0.25-y)mol+(0.75-3y)mol+2ymol=10
解得:y=0.075mol
则氢气的转化率为:3×0.075mol0.75mol×100%=30.0%.
答:此时H2的转化率为30%.
本题解析:
本题难度:一般
3、填空题 常温、常压下,可发生如下反应:A(g)+B(g)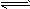 C(g)+nD(g),若将2molA和2molB混合充入体积可变的密闭容器中,在不同条件下达到平衡时,C的浓度如下
C(g)+nD(g),若将2molA和2molB混合充入体积可变的密闭容器中,在不同条件下达到平衡时,C的浓度如下
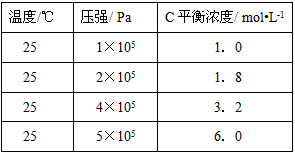
(1)可逆反应中,化学计量数n取值范围为__________,理由是____________________。
(2)在5×105Pa时,D的状态为____________________。
参考答案:(1)n>1;压强增加到2倍,C的浓度只增加到1.8倍,说明增大压强平衡向逆反应方向移动,正反应是气体物质的量增大的反应,故n>1
(2)固态或液态
本题解析:
本题难度:一般
4、选择题 电镀废液中Cr2O72-可通过下列反应转化成铬黄(PbCr4):Cr2O72-(aq)+2Pb2+(aq)+H2O(l)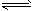
2PbCrO4(s)+2H+(aq) ΔH< 0 该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是
[? ]
A.
B.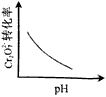
C.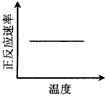
D.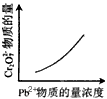
参考答案:A
本题解析:
本题难度:一般
5、选择题 如图是恒温下某反应的反应速率随时间变化的示意图,下列叙述与示意图不相符合的是

[? ]
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态I后,增大反应物浓度,平衡发生移动,达到平衡态II
C.该反应达到平衡态I后,减小反应物浓度,平衡发生移动,达到平衡态II
D.同一种反应物在平衡态I和平衡态II时浓度不相等
参考答案:C
本题解析:
本题难度:一般