微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 市售氯化钾中所含杂质以Na+、Mg2+为主,也含有少量SO42—、Fe3+等。提纯过程如下:
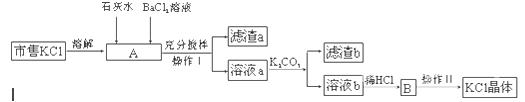
(1)操作I所用的玻璃仪器有?;操作II的主要步骤是?。
(2)滤渣a的主要成分是?;滤渣b的主要成分是?。
(3)检验BaCl2溶液是否加入过量,其详细操作过程为?。
(4)产品KCl晶体可能仍含少量的NaCl,进一步提纯的方法是?。
参考答案:(16分)
(1)漏斗、烧杯、玻璃棒(3分)?蒸发浓缩、冷却结晶、过滤洗涤烘干(3分)
(2)Mg(OH)2、Fe(OH)3、BaSO4(3分)? CaCO3、BaCO3(2分)
(3)向上层清液中滴加几滴BaCl2溶液,若有沉淀生成,则未过量,若无沉淀生成,则已过量(3分)
(4)重结晶(2分)
本题解析:(1)根据操作I的目的是从混合物中分离滤渣和溶液,说明I是过滤,需要使用烧杯、漏斗、玻璃棒;II的目的是从B溶液中制取KCl晶体,说明II是结晶,主要步骤为蒸发浓缩、冷却结晶、过滤、洗涤、烘干;(2)加入过量石灰水,其中的氢氧根与铁离子、镁离子分别结合成氢氧化铁沉淀、氢氧化镁沉淀,加入过量氯化钡溶液,其中的钡离子与硫酸根离子结合生成硫酸钡沉淀,但它们引入钙离子、氢氧根、钡离子等新杂质,则滤渣a的主要成分Fe(OH)3、Mg(OH)2、BaSO4;溶液a中加入过量的K2CO3时,其中的碳酸根离子与钙离子、钡离子分别结合生成碳酸钙沉淀、碳酸钡沉淀,但是引入的碳酸根离子是新杂质,则滤渣b的主要成分是CaCO3、BaCO3;(3)将悬浊液A静置之后,向上层清液中滴加几滴BaCl2溶液,若有白色沉淀生成,则BaCl2未过量,若无白色沉淀生成,则BaCl2已过量;(4)对于已经使用结晶法制取的氯化钾晶体,除去其中所含少量NaCl的方法是重结晶。
本题难度:一般
2、填空题 同一种制备装置可用于制取不同的气体,若只用如图装置制取气体,则:
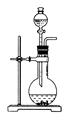
(1)请在下表空格中填上所需药品。
所制气体
| 药品
|
分液漏斗内
| 烧瓶中
|
O2
| ?
| MnO2
|
H2
| 稀H2SO4
| ?
|
NH3
| ?
| CaO
|
NO
| 稀HNO3
| Cu
|
CO2
| 稀H2SO4
| 石灰石
|
C2H4
| C2H5OH
| 稀H2SO4
|
C2H2
| ?
| CaC2
|
?
(2)写出表中药品制备O2的化学方程式?。
(3)写出表中药品制备C2H2的化学方程式?。
(4)请画出干燥NH3的装置图,并标明干燥剂和气体流向。
(5)表中给全药品的项目中,不能用于制备相应气体的有(可不填满)。
①气体?,理由?。
②气体?,理由?。
③气体?,理由?。
参考答案:(1)H2O2;锌粒;浓氨水;H2O
(2)2H2O2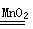 2H2O+O2↑
2H2O+O2↑
(3)CaC2+2H2O―→C2H2↑+Ca(OH)2
(4)如图所示。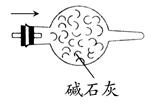
(5)①CO2;稀硫酸与石灰石反应生成的CaSO4微溶,覆盖于石灰石表面,阻止了稀硫酸与石灰石的进一步反应 ②C2H4;C2H5OH必须在浓硫酸催化作用下加热,且要控制温度在170℃时才能生成C2H4。
本题解析:该装置可用于固+液(或液+液)不需加热制取气体。
本题难度:一般
3、填空题 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。回答下列问题:
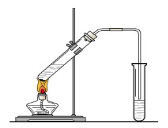
(1)写出制取乙酸乙酯的化学反应方程式: ? ?。
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法(加入试剂顺序)是:?。
(3)浓硫酸的作用是:①?;②?。
(4)饱和碳酸钠溶液的主要作用是?
?。
(5)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止? 。
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 ?
参考答案:(1)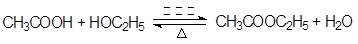
(2)先加乙醇,再缓慢滴加浓硫酸,最后滴加乙酸
(3)①催化剂;②吸水剂。
(4)中和乙酸,溶解乙醇,析出乙酸乙酯;
(5)防止倒吸,
(6)分液
本题解析:(1)在催化剂的作用下,乙酸和乙醇发生酯化反应生成乙酸乙酯,则该反应的化学方程式是 。
。
(2)由于浓硫酸的密度大于水的,且溶于水放热。又因为乙醇和乙酸都是挥发性的,所以加入试剂的先后顺序是先加乙醇,再缓慢滴加浓硫酸,最后滴加乙酸。
(3)在反应中浓硫酸起到催化剂的作用。又因为该反应是可逆反应,且有水生成,所以浓硫酸还起到吸水剂的作用。
(4)由于生成的乙酸乙酯中含有乙醇和乙酸,且乙酸乙酯不溶于水,所以饱和碳酸钠溶液的作用是中和乙酸,溶解乙醇,降低乙酸乙酯的溶解度,便于析出乙酸乙酯。
(5)由于生成的乙酸乙酯中含有乙醇和乙酸,而乙酸和乙醇与水都是互溶的,乙醇不能插入到溶液中的原因是防止倒吸。
(6)由于乙酸乙酯不溶于水,所以若要把制得的乙酸乙酯分离出来,应采用的实验操作是分液。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生实验能力的培养和解题方法的指导与训练,有助于培养学生规范、严谨的实验设计能力。该类试题主要是以实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。
本题难度:一般
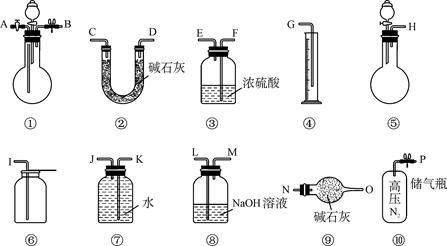
4、实验题 (15分)某过碳酸钠中含有少量过氧化钠,甲.乙两位同学各称取一定质量的该样品,并用如下图所示仪器测定样品的纯度。仪器的连接顺序,甲同学:⑤—⑧—③—⑦—④;乙同学:⑤—③—②。
已知:过碳酸钠(Na2CO4).过氧化钠分别跟足量稀硫酸反应的化学方程式如下:
2Na2CO4+2H2SO4===2Na2SO4+2CO2↑+O2↑+2H2O;
2Na2O2+2H2SO4===2Na2SO4+O2↑+2H2O。
(1)甲同学想通过实验测得的数据是____________,他选用的装置________(填序号)是没有必要的。实验中甲同学测得气体体积为V L (20 ℃,1大气压),计算时他未将V L换算到标准状况,则他得到的Na2CO4的质量分数________(填“偏高”或“偏低”")。
(2)乙同学想通过实验测得的数据是________________。按他测得的数据计算出的实验结果有可能偏高,原因是________________;也有可能偏低,原因是 。
(3)为了测得准确的实验数据,请你将乙同学的实验设计进行改进,写出你所选用仪器的连接顺序(每种仪器最多使用一次,也可以不用):________________(填序号)。
参考答案:(1)生成的氧气的体积(2分) ③(2分) 偏低(2分)
(2)生成的二氧化碳的质量(2分) 空气中的水与二氧化碳进入②增重使结果偏大(2分) 产生的二氧化碳在装置⑤.③及导管中没有完全被②吸收使结果偏小(2分)
(3)⑩①③②⑨(3分)
本题解析:(1)根据甲的实验原理可知,甲是想通过测量排出的水的体积来计算生成的氧气体积,进而来计算样品的纯度的,所以将氧气干燥是多余的。若未将未将V L换算到标准状况,则其体积偏大。而根据方程式可以看出,在质量相等时过氧化钠生成的氧气要多。所以Na2CO4的质量分数偏小。
(2)由乙的实验原理可知,乙是通过测量生成的二氧化碳的质量来测定其纯度的。由于空气中含有水饱和二氧化碳,所以有可能使装置②的质量增加,导致结果偏大。如果反应中生成的二氧化碳没有被②完全吸收,也有可能使测定的结果偏低。
(3)要使结果更准确,就必须使反应中生成的二氧化碳完全被碱石灰吸收,而且还需要保证空气中的水和二氧化碳不参与反应,所以正确的顺序是⑩①③②⑨。
本题难度:一般
5、选择题 下列气体能用下图所示装置收集的是(?)
A.C2H4
B.CO2
C.CH4
D.Cl2
