微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 某100mL的CuCl2溶液中,已知溶液中的Cl-的浓度为0.2mol/L.现将一定量的铁粉投入到该溶液中,若反应后溶液的体积不变,回答下列问题:
(1)写出该反应的离子方程式______;
(2)原溶液中Cu2+的浓度为______;反应后测得Cl-的浓度为______mol/L;
(3)反应中氧化剂是______,氧化产物是______;
(4)反应后测得溶液中Fe2+的浓度为0.05mol/L,则反应中转移电子______个.
参考答案:(1)铁与氯化铜反应生成铜与氯化亚铁,反应离子方程式为:Fe+Cu2+=Fe2++Cu,故答案为:Fe+Cu2+=Fe2++Cu;
(2)由化学式CuCl2可知,CuCl2溶液中c(Cu2+)=12c(Cl-)=12×0.2mol/L=0.1mol/L;
加入一定量的铁粉,发生反应Fe+Cu2+=Fe2++Cu,Cl-不参加反应,体积不变,Cl-浓度不变为0.2mol/L,故答案为:0.1;0.2;
(3)发生反应Fe+CuCl2=FeCl2+Cu,反应中CuCl2→Cu,Cu元素化合价由+2价降低为0价,CuCl2是氧化剂;
反应中Fe→FeCl2,Fe元素化合价由0价升高为+2价,Fe是还原剂,故FeCl2是氧化产物,故答案为:CuCl2;FeCl2;
(4)n(Fe2+)=0.1L×0.05mol/L=0.005mol,反应中Fe→Fe2+,化合价由0价升高为+2价,转移电子物质的量为:0.005mol×2=0.01mol,
转移电子数目为:0.01mol×NAmol-1=0.01NA,故答案为:0.01NA.
本题解析:
本题难度:一般
2、计算题 铝及其化合物在生产生活中的应用广泛。
(1)Al4C3用于冶金及催化剂。与盐酸反应(产物之一是含氢量最高的烃)的化学方程式是: ;14.4g Al4C3与盐酸反应产生的气体是 L(标准状况)。
(2)AlN用于电子仪器。AlN中常混有少量碳,将一定量含杂质碳的AlN样品置于密闭反应器中,通入4.032L(标准状况下的)O2,在高温下充分反应后测得气体的密度为1.34g/L(已折算成标准状况,AlN不跟O2反应),则所得气体的摩尔质量为 g/mol,该气体的成分是 (写化学式),该样品中含杂质碳 g。
(3)氯离子插层镁铝水滑石是一种新型的离子交换材料。制备这种水滑石的过程是:MgCl2、AlCl3、NaOH、NaCl溶液,按一定比例混合,在65℃充分反应后,经过滤、洗涤、干燥得到该水滑石。为确定该水滑石的成分,进行如下操作:
①取26.65g样品,在高温下使其充分分解,得到金属氧化物和气体,气体依次通过足量的浓硫酸和浓氢氧化钠溶液,这两种液体分别增重9.9g和3.65g;将金属氧化物在无色火焰上灼烧,火焰仍无色。
②另取26.65g样品,加入足量的稀硝酸,使其完全溶解,再加入NaOH溶液至过量,最终得到11.6g白色沉淀。通过计算确定氯离子插层镁铝水滑石的化学式。
(4)氯离子插层镁铝水滑石在空气中放置,缓慢与CO2反应,部分氯离子会被碳酸根离子代替。26.65g样品在空气中放置一段时间后质量变为25.925g,则碳酸根离子代替部分氯离子的水滑石的化学式是 ,此过程的化学方程式 。
参考答案:(1)Al4C3+12HCl=3CH4+4AlCl3 6.72(0.1molAl4C3生成0.3mol甲烷)
(2)30.016 CO和CO2 3.84(十字交叉法求得CO 0.28mol CO2 0.04mol)
(3)Mg2Al(OH)6·3H2O
(4)

本题解析:(1)Al4C3与盐酸反应产物之一是含氢量最高的烃,可该烃是甲烷,根据水解原理可知化学方程式是:Al4C3+12HCl=3CH4+4AlCl3;14.4g Al4C3物质的量为0.1mol,生成0.3mol甲烷,体积6.72L。
(2)由气体的密度为1.34g/L乘以22.4可得气体的摩尔质量为30.016g/mol,该气体的成分是CO和CO2 ,不可能为氧气和CO2,因为两都的相对分子质量都比30.016大 。运用十字交叉法求得CO 0.28mol CO2 0.04mol,根据碳原子守恒,该样品中含杂质碳0.32mol。求得质量为3.84g。
(3)①取26.65g样品,在高温下使其充分分解,将金属氧化物在无色火焰上灼烧,火焰仍无色。说明没有钠元素。得到金属氧化物为氧化镁和氧化铝,气体是氯化氢和水,气体依次通过足量的浓硫酸和浓氢氧化钠溶液,这两种液体分别增重9.9g(水为0.55mol)和3.65g(氯化氢为0.1mol);
②最终得到11.6g白色沉淀是氢氧化镁,物质的量为0.2mol。

(4)“部分氯离子会被碳酸根离子代替”,由化合价守恒或称电荷守恒,2个氯离子取代一个碳酸根离子。设被替换的Cl2x mol,则CO32- x mol。
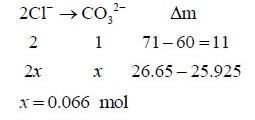 发现:消耗Cl0.132 mol,而26.65 g固体本身只有0.1 mol,即固体中只有0.1 mol Cl ,明显不符合题意。也就是说就算Cl全部转化为碳酸根,都无法得到25.925 g固体。设1 mol该化合物吸收a mol CO2,则消耗a mol H2O,替换2a mol Cl 。即该化合物的化学式:
发现:消耗Cl0.132 mol,而26.65 g固体本身只有0.1 mol,即固体中只有0.1 mol Cl ,明显不符合题意。也就是说就算Cl全部转化为碳酸根,都无法得到25.925 g固体。设1 mol该化合物吸收a mol CO2,则消耗a mol H2O,替换2a mol Cl 。即该化合物的化学式: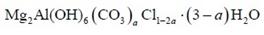

考点:本题主要考查化学计算,最后一问难度很大。
本题难度:困难
3、填空题 (1)等物质的量的NO2?和N2O中所含O原子个数之比______,N原子数之比______,二者的质量之比______,在标准状况下的体积之比______.
(2)在______?mol?Al2(SO4)3中含1.8mol?SO42-,其中含Al3+______个.
参考答案:(1)NO2?和N2O的物质的量相等,所以NO2?和N2O的分子数相等;一个NO2?分子中含2个O原子,一个N2O分子中含1个O原子,所以所含O原子个数之比为2:1;
一个NO2?分子中含1个N原子,一个N2O分子中含2个N原子,所以所含N原子个数之比为1:2;
其质量比等于其摩尔质量之比=46g/mol:44g/mo=l23:22;
在标准状况下的体积之比等于其物质的量之比=1:1;
故答案为:2:1;? 1:2;? 23:22;? 1:1
(2)Al2(SO4)3--2 Al3+--3SO42-
? ?1? 2? 3
0.6?mol? 1.2?mol? ?1.8 mol
所以Al2(SO4)3的物质的量为?0.6?mol,Al3+?的物质的量为1.2?mol,
N(Al3+)=nNA=1.2?mol×6.02×1023个/mol=1.2×6.02×1023个,
故答案为:0.6?mol;1.2×6.02×1023个
本题解析:
本题难度:一般
4、选择题 用 NA表示阿伏加德罗常数的数值,下列说法正确的是
A.常温常压下,11.2 L 乙烯所含碳原子数为NA
B.1L 0.1 mol?L-1的Al2(SO4)3溶液中,Al3+的数目为0.2 NA
C.32g O2和 O3的混合气体中含有的氧原子数为2NA
D.5.6 g铁粉在0.1 mol氯气中充分燃烧,转移电子数为0.3NA