微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将一质量分数为ω的KOH溶液蒸发掉m g水后,质量分数恰好变为3ω,体积为VL(溶液中无晶体析出),则浓缩后溶液的物质的量浓度为(?)
A.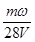 mol·L-1
mol·L-1
B.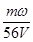 mol·L-1
mol·L-1
C.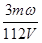 mol·L-1
mol·L-1
D.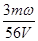 mol·L-1
mol·L-1
参考答案:C
本题解析:设浓缩前溶液的质量是x,则根据浓缩过程中溶质不变可知,x×ω=(x-m)×3ω,解得x=1.5m,即溶液中溶质的质量是1.5mω,物质的量是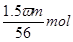 ,所以浓缩后溶液的物质的量浓度是
,所以浓缩后溶液的物质的量浓度是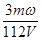 mol·L-1 ,答案选C。
mol·L-1 ,答案选C。
点评:该题是高考中的常见题型,属于基础性计算题的考查,难度不大。明确浓缩前后溶质不变是解题的关键,有利于培养学生的逻辑思维能力和规范答题能力。
本题难度:一般
2、选择题 下列有关配制1 mol·L-1CuSO4溶液的操作正确的是(? )
A.用托盘天平准确称量硫酸铜晶体(CuSO4·5H2O)25 g,溶解于500 mL水中且准确称取硫酸铜晶体25 g,溶于水后配成100mL溶液
C.加热硫酸铜晶体至失去全部结晶水后,准确称取无水硫酸铜32 g,溶于200 mL水中
D.准确称取硫酸铜晶体50 g,溶于水后配成500mL溶液
参考答案:BD
本题解析:C中操作没有必要,可直接用CuSO4晶体。
本题难度:简单
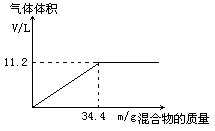
3、计算题 在100mLNaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应,下图表示加入的混合物的质量和产生气体的体积(标准状况)关系。
(1)试计算NaOH溶液的物质的量浓度。
(2)当NaOH溶液的体积为140mL,固体混合物的质量为51.6g,充分反应后,生成气体的体积(标准状况)为多少升?
(3)当NaOH溶液的体积为180mL,固体混合物的质量仍为51.6g,充分反应后,生成气体的体积(标准状况)为多少升?
参考答案:解:(1)5mol/L (3分)?(2)15.68 L(3分)(3)16.8L(3分)
本题解析:考查化学计算的过量与不足问题
(1)由图像可知,随着混合物的质量的增加,所得到的氨气的最大体积为11.2L
由反应NH4++OH- NH3↑+H2O可知,OH-的物质的量为0.5mol,NaOH溶液的物质的量浓度为5mol/L
NH3↑+H2O可知,OH-的物质的量为0.5mol,NaOH溶液的物质的量浓度为5mol/L
34.4g混合物中所含NH4+的量为0.5mol,设NH4NO3、(NH4)2SO4的物质的量分别为x、y
80x+132y=34.4? x+2y=0.5
解得x=0.1mol? y=0.2mol,即两者的物质的量比为1:2
(2)140mlNaOH提供的OH-的物质的量为0.7mol
固体混合物的质量为51.6g,可计算出NH4NO3、(NH4)2SO4的物质的量分别为0.15mol、0.3mol,提供NH4+的量为0.75mol
由反应NH4++OH-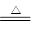 NH3↑+H2O可知,OH-的量相对不足,生成的氨气为0.7mol,标准状况下体积为22.4×0.7=15.68 L
NH3↑+H2O可知,OH-的量相对不足,生成的氨气为0.7mol,标准状况下体积为22.4×0.7=15.68 L
(3)180mlNaOH提供的OH-的物质的量为0.9mol,与固体相比NH4+的量不足,所生成氨气为0.75mol,标准状况下体积为22.4×0.75=16.8L
本题难度:简单
4、简答题 在?NaCl与MgCl2的混合液中,Na+与Mg2+的物质的量之比为1:2.如果混合液中共有0.5mol?Cl-,溶液的体积为0.5L,则混合液中氯化钠的质量为______;MgCl2的物质的量浓度为______.
参考答案:NaCl与MgCl2的混合液中共有0.5mol?Cl-,根据电荷守恒有n(Na+)+2n(Mg2+)=n(Cl-),由于Na+与Mg2+的物质的量之比为1:2,则:
n(Na+)+2×2n(Na+)=0.5mol,
解得n(Na+)=0.1mol,故n(Mg2+)=2n(Na+)=0.1mol×2=0.2mol,
所以n(NaCl)=n(Na+)=0.1mol,氯化钠的质量为0.1mol×58.5g/mol=5.85g,
n(MgCl2)=n(Mg2+)=0.2mol,氯化镁的物质的量浓度为0.2mol0.5L=0.4mol/L,
故答案为:5.85g;0.4mol/L.
本题解析:
本题难度:一般
5、选择题 设NA代表阿伏加德罗常数,下列说法正确的是(? )
A.2.3 g金属钠变成钠离子时失去的电子数目为0.2NA
B.2 g氢气所含原子数目为NA
C.17 g NH3所含的电子数为10NA
D.NA个氧分子和NA个氢分子的质量比等于16∶1
参考答案:CD
本题解析:A中2.3 g钠的物质的量为0.1 mol,每1 mol钠变成钠离子时失去1 mol电子,故2.3 g钠应失去0.1 mol电子,即失去的电子数为0.1NA。B中氢气是由氢分子组成的物质,氢分子是双原子分子,其相对分子质量为2,故2 g氢气所含的氢分子数目为NA,氢原子数目应为2NA。C中NH3是含有10个电子的分子,其相对分子质量为17,故17 g NH3的物质的量为1 mol,所含电子的物质的量为10 mol,电子数目为10NA。D中由NA个氧分子的质量在数值上等于它的摩尔质量,NA个氢分子的质量在数值上等于它的摩尔质量,故二者的质量比为32 g∶2 g=16∶1。
本题难度:简单