|
高中化学知识点讲解《化学平衡的移动和应用》在线测试(2017年最新版)(二)
2017-11-05 20:31:58
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 可逆反应A(g)+B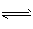 C(g)+D的反应式中A和C都是无色气体。当反应达到平衡时,下列叙述错误的是? C(g)+D的反应式中A和C都是无色气体。当反应达到平衡时,下列叙述错误的是?
? [? ]
A.若增大A的浓度,平衡体系颜色加深,则说明D是有颜色的气体
B.若升高温度,C的百分含量减小,则说明逆反应为吸热反应
C.若增大压强,平衡不发生移动,则说明B和D一定都是气体
D.如果B是气体,则增大A的浓度会使B的转化率增大
参考答案:C
本题解析:
本题难度:一般
2、选择题 已知反应:3A(g)+B(g)

C(s)+4D(g);△H=-Q?kJ/lmol下列分析错误的是( )
A.在恒温密闭容器中,共加入1molA和B的混合物,发生反应,当A的转化率与B的转化率相等时,则最初加入B的量为0.25mol
B.在恒温下,加入过量的C和1mol的D反应达到平衡后,再加入1molD,同时压强再增大一倍,建立起新的化学平衡后,A的浓度将增加到原平衡的4倍
C.如果在C(s)中含有难熔性的杂质,将其放在下列装置的b点处,并充入一定量的D(g),一段时间后,可在a点处得到纯C(S)
D.当反应向逆反应方向进行时,v逆(B)>3v(A)正
| 
参考答案:A、在恒温密闭容器中,共加入1molA和B的混合物,发生反应,当A的转化率与B的转化率相等时,混合物的起始量一定按照化学方程式中的反应比投料.即1molAB按照3:1组成,A物质的量为0.75mol,B物质的量为0.25mol,故A正确;
B、3A(g)+B(g)

C(s)+4D(g);中C为,固体对平衡无影响,反应前后气体体积不变,加入过量的C和1mol的D反应达到平衡后,A的浓度将增加到原平衡的1倍,再加入1molD相当于增大压强,A的浓度又增大到原来的2倍,压强再增大一倍,平衡不动,相当于体积变为原来的一半,建立起新的化学平衡后,A的浓度将增加到原平衡的4倍,故B正确;
C、利用C中含的杂质是难溶物熔沸点高,把含杂质的C放在高温区,通入D气体,反应是放热反应,高温平衡逆向进行,生成ABD的平衡气体在a点温度降低,平衡正向进行,生成纯净C固体,故C正确;
D、反应的正反应速率之比等于系数之比,v正(A):v正(B)=3:1,当反应向逆反应方向进行时对于B,v正(B)<v逆(B),所以v逆(B)>13v(A)正,故D错误;
故选D.
本题解析:
本题难度:简单
3、选择题 下列事实不能用勒夏特利原理来解释的是( )
A.增大压强,有利于SO2和O2反应生成SO3
B.热的纯碱溶液去油污能力较强
C.加催化剂使N2和H2在一定条件下转化为NH3
D.常温下,pH=3的H2SO4溶液中水的电离程度小于pH=3的NH4Cl溶液中水的电离程度
参考答案:A.存在平衡2SO2+O2(g)?2SO3(g),正反应为气体体积减小的反应,增大压强,平衡向正反应移动,有利于合成SO3,能用勒夏特利原理解释,故A不选;
B.碳酸根水解CO32-+H2O?HCO3-+OH-,溶液呈碱性,水解过程是吸热过程,升高温度促进碳酸根水解,碱性增强,去油污能力增强,能用勒夏特利原理解释,故B不选;
C.催化剂能极大加快反应速率,不影响化学平衡移动,不能用勒夏特利原理解释,故C选;
D.硫酸电离出氢离子,抑制水的电离,铵根离子水解NH4++H2O?NH3?H2O+H+,促进水的电离,能用勒夏特利原理解释,故D不选;
故选C.
本题解析:
本题难度:一般
4、简答题 硫酸生产主要有硫磺法和硫铁矿法等,这两种制法均经过催化氧化步骤.
(1)钒触媒(V2O5)能加快SO2的氧化速率,此过程中SO2先与V2O5反应生成V2O4.该过程的化学方程式可表示为______.
(2)为测定过程中混合气的SO2体积分数,选用0.0500mol/LI2的标准溶液、淀粉溶液进行测定.已知:V(耗用I2标准溶液)=10.00mL,V(采集烟气)=100.0mL(已折算为标准状况),则烟气中SO2的体积分数为______.
(3)一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示.试分析工业生产中采用常压的原因是______.
(4)在温度相同、体积均为1L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下.
已知:2SO2(g)+O2(g)?2SO3(g);△H=-98.3kJ?mol-1.
| 容器 | 甲 | 乙 | 丙
反应物投入量
2molSO2、1molO2
2molSO3
mmolSO2、nmolO2、pmolSO3
c(SO3)/mol?L-1
1.4
1.4
1.4
能量变化
放出akJ
吸收bkJ
吸收ckJ
SO2或SO3的转化率
α1
α2
12.5%
|
则α1+α2=______,p=______mol,b+c=______kJ.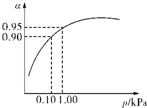
参考答案:(1)SO2先与V2O5反应生成V2O4,V2O5参与反应作氧化剂,本身被还原为V2O4则二氧化硫被氧化为三氧化硫,
故答案为:SO2+V2O5?V2O4+SO3;
(2)根据公式n=c×v,I2的物质的量为n=0.0500mol/L×0.01L=5×10-4mol,根据反应:
? SO2 +I2 +2H2O=H2SO4+2HI
?5×10-4mol?5×10-4mol
标准状况下的体积为5×10-4mol×22.4L/mol=1.12×10-2L.V(采集烟气)=100.0mL(已折算为标准状况),则烟气中SO2的体积分数为0.0112L0.1L=0.112.故答案为:0.112;
(3)当压强为0.1KPa时,SO2的转化率为0.90,SO2的转化率已很高,当压强为1.0KPa时,SO2的转化率为0.95;
此时,对设备、能源都有很高的要求,压强的增加引起SO2转化率的变化并不明显,经济上不划算,
故答案为:在常压时,SO2的转化率已很高,若加压,则对设备、能源等有较高的要求,经济上不划算;
(4)在温度相同、体积均为1L的三个密闭容器中,SO3的物质的量均为1mol.化学平衡状态的达到与化学反应途径无关.在相同的条件下,可逆反应,无论从正反应开始还是从逆反应开始,还是从既有反应物又有生成物开始,达到的化学平衡状态是相同的,平衡混合物中各组成物质的百分含量保持不变,就是等效平衡.三个密闭容器,保持恒温、恒容,最终c(SO3)=1.4?mol?L-1.三个容器中的反应为等效平衡.体积均为1L,最终n(SO3)=1.4?mol.
甲? ?2SO2(g)+O2(g)?2SO3(g);△H=-98.3kJ?mol-1.
起始量(mol)? 2? ? 1? ? ? 0
变化量?(mol)? 1.4? 0.7? 1.4-98.3kJ×1.42=68.81KJ?
平衡量?(mol)? ?0.6? ? 0.3?
故a=68.81,α1=1.4?2=0.7,
乙容器保持恒温、恒容,和甲容器中反应为等效平衡.故b=98.3kJ×(2-1.4)/2=29.49kJ.该反应从三氧化硫开始,α2=2-1.42=0.3,α1+α2=0.7+0.3=1.
丙? 2SO2(g)+O2(g)?2SO3(g);△H=-98.3kJ?mol-1.吸收ckJ说明反应从逆反应方向开始.
起始量(mol)?m?n? ?p
变化量?(mol)?0.2?0.1?1.4÷(1-12.5%)-1.4?
平衡量?(mol)?m+0.2?n+0.1? 1.4?
P=1.4÷(1-12.5%)=1.6,c=98.3kJ×(1.6-1.4)/2=9.83
b+c=29.49+9.83=39.32kJ,
故答案为:1;1.6;39.32.
本题解析:
本题难度:一般
5、选择题 某温度下,在一容积固定的容器中,反应aA(g)+bB(g)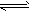 hH(g)达到平衡后,A、B、H的物质的量分别为amol、b mol和hmol。已知a+b=h,若保持温度不变,将三者的物质的量增大一倍,则下列判断正确的是 hH(g)达到平衡后,A、B、H的物质的量分别为amol、b mol和hmol。已知a+b=h,若保持温度不变,将三者的物质的量增大一倍,则下列判断正确的是
[? ]
A.气体的平均相对分子质量变大
B.平衡不移动
C.B的体积分数减少
D.混合气体的密度不变
参考答案:B
本题解析:
本题难度:一般
| 
