1、实验题 (11分)某同学按下列步骤配制500 mL 0.2 mol·L-1 KCl溶液,请回答下列问题:
实验步骤
| 有关问题
|
(1)计算所需KCl的质量
| 需要KCl的质量为______g
|
(2)称量KCl固体
| 称量过程中主要用到的仪器有________________
|
(3)将KCl放入到100 mL烧杯中加水溶解
| 为加快溶解速度,可采取的措施是______________________
|
(4)将烧杯中的溶液转移至500 mL容量瓶中
| 为防止溶液溅出,应采取的措施是____________________
|
(5)向容量瓶中加蒸馏水到刻度线
| 在进行此操作时应注意的问题是__________________________
|
你认为按上述步骤配制的KCl溶液的浓度是否为0.2 mol·L-1,请说明理由。
2、实验题 (10分)某兴趣小组同学共同设计了如图所示的实验装置。该装置既可用于制取气体,又可用于验证物质的性质。
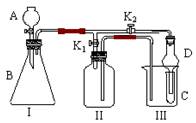
⑴打开K1关闭K2,可制取某些气体。
甲同学认为装置I可用于制取H2、NH3、O2,但装置II只能收集H2、NH3,不能收集O2。其理由是?。
乙同学认为在不改动装置II仪器的前提下,对装置II进行适当改进,也可收集O2。你认为他的改进方法是?。
⑵打开K2关闭K1,能比较一些物质的性质。
丙同学设计实验比较氧化性:KMnO4>Cl2>Br2。在A中加浓盐酸后一段时间,观察到C中的现象是?;仪器D在该装置中的作用是?。
丁同学用石灰石、醋酸、苯酚钠等药品设计了另一实验。他的实验目的是?。
3、实验题 (15分)阿司匹林(乙酰水杨酸,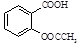 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的基本操作流程如下:
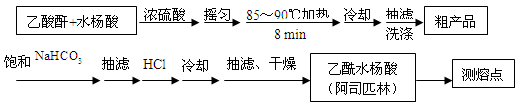
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是?。
(2)写出制备阿司匹林的化学方程式???。
(3)反应过程中,要控制温度在85 ℃~90 ℃,其原因是?,
应采用的加热方法是?。用这种方法加热需要的玻璃仪器有?。
(4)抽滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是???。
(5)如何检验产品中是否混有水杨酸????。
4、实验题 (14分)某研究性学习小组查阅资料得知,漂白粉与硫酸反应可以制得氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。
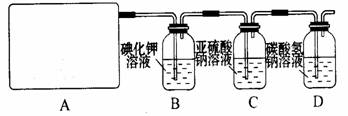
试回答:
(1)该实验中A部分的装置是 (填写装置的序号)。
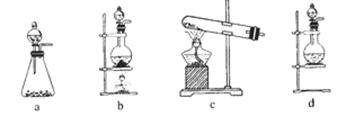
(2)请你设计一个实验,证明洗气瓶C中的Na2SO3已经被氧化(简述实验步骤):
。
(3)若D中反应后的溶液具有漂白性,请写出D装置中发生反应的离子方程式? 。
(4)该实验存在明显的缺陷,请你提出改进的方法 。
(5)该小组又进行了如下实验:取漂白粉适量,研磨后溶解,配制成漂白液,运用下列实验,检测该漂白液的性质。
①将少量漂白液滴入含有淀粉的KI溶液中,溶液中出现蓝色;
②用pH试纸检测漂白液,试纸边缘为蓝紫色(pH=13),中间部分为白色;
③向漂白液中加入少量稀硫酸,溶液变为黄绿色,产生使湿润的淀粉KI试纸变蓝的气体。
请回答以下问题:
a、实验①表现出该消毒液具有 性;
b、实验②用pH试纸检测消毒液的操作是 _______________________;
c、实验③中涉及反应的离子方程式为 ____________;
5、简答题 溴化锂常用于制冷工业,可用尿素、碳酸锂及溴为原料生产溴化锂,其原理是
3Br2+3Li2CO3+CO(NH2)2 6LiBr+2H2O+N2↑+4CO2↑其主要工艺流程如下:
6LiBr+2H2O+N2↑+4CO2↑其主要工艺流程如下:
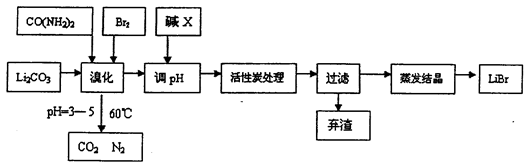
(1)溴化时,pH过小对反应不利,一方面是因为碳酸锂会反应生成_____________,另一方面使溴单质和水的反应平衡向_______移动,温度不宜超过60℃的原因是_______。
(2)反应过程中,若pH>6,产品中会有溴酸盐,其原因是BrO-发生了自身的氧化还原反应,写出反应的离子方程式:________________。
(3)试剂X的化学式为_____________,加活性炭处理的目的是________________。
(4)若直接用氨水代替尿素也可生产溴化锂,同时生成水、二氧化碳和氮气,该反应的化学方程式为_________________。
(5)用惰性电极电解熔融碳酸锂可得到金属锂,则阳极的电极方程式为______________。
(6)若原料中碳酸锂的质量为mg,最终得到溴化锂的质量为ng,据此能不能计算出溴化锂的产率?若能请写出其表达式(含m、n的表达式);若不能,请说明理由______________。