1、判断题 (12分)2009年10月1日,我国成功举办国庆六十年阅兵活动。其中阅兵仪式上9辆电动车与混合动力车等新能源车辆的亮相,展示了综合国力、国防科技发展水平。同时也说明能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g)? ?CH3OH(g)?ΔH1
?CH3OH(g)?ΔH1
反应Ⅱ: CO2(g) + 3H2(g)  ?CH3OH(g)? +? H2O(g)?ΔH2
?CH3OH(g)? +? H2O(g)?ΔH2
① 上述反应符合“原子经济”原则的是? _____(填“Ⅰ”或“Ⅱ”)。
② 下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
温度
| 250℃
| 300℃
| 350℃
|
K
| 2.041
| 0.270
| 0.012
|
?
由表中数据判断ΔH1?0 (填“>”、“=”或“<”)。?
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为?,此时的温度为?(从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g)?ΔH1= -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g)?ΔH2= -566.0 kJ/mol
③ H2O(g) = H2O(l)?ΔH3= -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:?
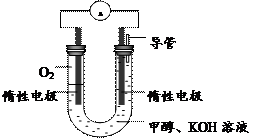 (3)某实验小组依据甲醇燃烧的反应原理,
(3)某实验小组依据甲醇燃烧的反应原理,
①设计如右图所示的电池装置。该电池正极的电极反应为
?。
② 工作一段时间后,测得溶液的pH减小,
该电池总反应的化学方程式为
?。
参考答案:(1)① I?② <?③ 80%? 250℃?
(2) CH3OH(l)+ O2(g) = CO(g) + 2H2O(l)? ΔH=﹣442.8 kJ∕mol
(3)① O2 + 2H2O + 4e- ="?" 4OH-?
② 2CH3OH + 3O2 + 4OH- = 2CO32- + 6H2O
本题解析:(1)①反应Ⅰ的产物只有甲醇,而反应Ⅱ的产物有两种,故反应Ⅰ符合“原子经济”原则;②观察图表数据可得,升温时,K值变小,说明该反应的正反应为放热反应,即ΔH1<0;③CO的转化率="[2" mol- 0.2 mol/L×2L]/2mol×100%= 80%;此时的化学平衡常数为K= c(CH3OH)/ c(CO)× c2(H2)="0.8" mol.L-1/0.2 mol.L-1×(1.4 mol.L-1)2=2.041,故此时的温度为250℃。
(2)将三个热化学方程式进行变形:①+[-②]+4×③,可得甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式,即CH3OH(l)+ O2(g) = CO(g) + 2H2O(l),ΔH=ΔH1+[-ΔH2]+4ΔH3=﹣442.8 kJ∕mol
(3)②先写出甲醇燃烧的反应式为2CH3OH + 3O2 = 2CO2 + 4H2O 、2CO2?+ 4KOH=2K2CO3 + 2H2O,将以上两式进行合并,可得该电池的总反应式为 2CH3OH + 3O2 + 4OH- = 2CO32- + 6H2O 。
本题难度:一般
2、选择题 许多国家十分重视海水资源的综合利用,不需要化学变化就能从海水中获得的物质是( )。
A.Cl2、Br2、I2
B.Na、Mg、Al
C.食盐、淡水
D.NaOH、H2
参考答案:C
本题解析:A、B、D中的物质必须经化学变化,才能够从海水中获取。
本题难度:一般
3、选择题 想一想,下面三个词为什么归纳在一起?然后从所给的四个词中选出一个与它们同类.陶瓷、玻璃、水泥( )
A.光导纤维
B.有机玻璃
C.人造纤维
D.砖瓦
参考答案:D
本题解析:
本题难度:一般
4、填空题 焦亚硫酸钠(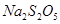 )常用作食品漂白剂,其制备工艺流程如下:
)常用作食品漂白剂,其制备工艺流程如下:
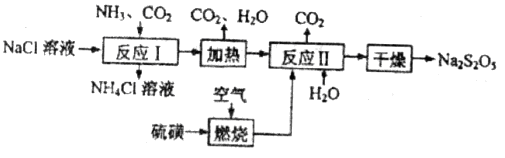
已知:反应Ⅱ包含 等多步反应。
等多步反应。
(1)反应Ⅰ的化学方程式为____________,反应Ⅰ进行时应先通入__________气体。
(2)硫磺燃烧前先加热成液态并通过喷嘴喷入焚硫炉中,目的是__________。在上述工艺流程中可循环使用的物质是_____________。
(3)反应Ⅱ中需控制参加反应的气体与固体的物质的量之比接近____________,若气体量不足,则会导致_______________。
(4)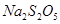 与稀硫酸反应放出
与稀硫酸反应放出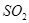 ,其离子方程式为___________。
,其离子方程式为___________。
参考答案:(1)CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl,NH3(1分)
(2)增大硫与空气的接触面积,使硫磺充分燃烧,加快反应速率,CO2和H2O
(3)2:1(1分),Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加,Na2S2O5产率降低。
(4)S2O52—+2H+=2SO2↑+H2O。
本题解析:(1)本题考查侯德榜制碱法的原理,利用碳酸氢钠的溶解度较小,反应方程式为CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl,二氧化碳在水中的溶解度不大,氨气极易溶于水,为提高溶液中碳酸氢根的浓度,应先通入氨气;(2)硫磺燃烧前先加热成液态并通过喷嘴喷入焚硫炉中,目的是增大硫与空气的接触面积,使硫磺充分燃烧,加快反应速率;由流程图知,可循环利用的物质是CO2和H2O;(3)反应Ⅱ中涉及的反应为Na2CO3+2SO2+H2O=2NaHSO3,2NaHSO3 Na2S2O5+H2O,参加反应的气体与固体的物质的量之比接近2:1,若气体量不足,则会导致Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加,Na2S2O5产率降低。(4)Na2S2O5与稀硫酸反应放出SO2,其离子方程式为S2O52—+2H+=2SO2↑+H2O。
Na2S2O5+H2O,参加反应的气体与固体的物质的量之比接近2:1,若气体量不足,则会导致Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加,Na2S2O5产率降低。(4)Na2S2O5与稀硫酸反应放出SO2,其离子方程式为S2O52—+2H+=2SO2↑+H2O。
本题难度:一般
5、选择题 祖母绿是含铬(以Cr2O3形式存在)等微量元素的矿物,其主要成分为Be3Al2Si6O18
(Be3Al2Si6O18为无色透明),下列说法不正确的是
A.祖母绿是一种硅酸盐矿物
B.其主要成分可用氧化物形式表示:3BeO·Al2O3·6SiO2
C.绿色是Cr2O3表现出来的
D.祖母绿是多种氧化物组成的混合物
参考答案:D
本题解析:
答案:D
D.不正确,祖母绿是硅酸盐。
本题难度:简单