1、选择题 某氯化镁溶液的密度为1.18g?cm-3,其中镁离子的质量分数为5.11%.300mL该溶液中Cl-离子的物质的量约等于
A.0.37mol
B.0.63mol
C.0.74mol
D.1.5mol
参考答案:D
本题解析:分析:根据c= 计算镁离子的物质的量浓度,再利用MgCl2可知,c(Cl-)=2c(Mg2+),以此来解答.
计算镁离子的物质的量浓度,再利用MgCl2可知,c(Cl-)=2c(Mg2+),以此来解答.
解答:氯化镁溶液的密度为1.18g?cm-3,其中镁离子的质量分数为5.11%,
则c(Mg2+)=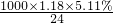 ≈2.5mol/L,
≈2.5mol/L,
c(Cl-)=2c(Mg2+)=5.0mol/L,
所以300mL该溶液中Cl-离子的物质的量约等于0.3L×5.0mol/L=1.5mol,
故选D.
点评:本题考查物质的量及浓度的有关计算,明确浓度与质量分数的换算公式即可解答,难度不大.
本题难度:困难
2、选择题 下列实验操作中,正确的是( )
A.配制5%NaCl溶液时,将已准确称量的NaCl放入烧杯中并加适量的水搅拌溶解
B.过滤时可用温度计代替玻璃棒
C.蒸发的过程,用酒精灯一直加热到全部固体析出,没有水分
D.分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出
参考答案:A
本题解析:
本题难度:一般
3、填空题 (18分)某同学用某种粗盐进行提纯实验,步骤见下图。

请回答:
(1)步骤①和②的操作名称是________________。
(2)步骤③判断加入盐酸“适量”的方法是____________________________________
步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止__________________,当蒸发皿中有较多量固体出现时,应__________________,用余热使水分蒸干。
(3)猜想和验证:
参考答案:(每空2分)
(1)过滤
(2) 滴加盐酸至无气泡放出为止 ?局部过热,造成固体(或溶液)飞溅 ?停止加热(或熄灭酒精灯)
滴加盐酸至无气泡放出为止 ?局部过热,造成固体(或溶液)飞溅 ?停止加热(或熄灭酒精灯)
(3)猜想Ⅰ:有气泡放出,烧杯底变浑浊(或石灰水变浑浊)
猜想Ⅱ:稀硝酸(或稀盐酸) ?猜想Ⅱ不成立
猜想Ⅲ:滴入BaCl2[或Ba(OH)2、或Ba(NO3)2]溶液和稀HNO3 ?有白色沉淀且不溶于稀HNO3
本题解析:略
本题难度:简单
4、选择题 为了除去括号内的杂质,其试剂选择和分离方法都正确的是
A.A
B.B
C.C
D.D
参考答案:B
本题解析:分析:A.溴苯、溴和苯互溶;
B.乙酸乙酯不溶于饱和碳酸钠溶液,乙酸能被碳酸钠溶液吸收;
C.乙烯被酸性高锰酸钾氧化为二氧化碳气体;
D.乙醇和水的分离应用蒸馏的方法.
解答:A.溴苯、溴和苯互溶,除去溴苯的中溴,应用碱溶液,然后分液,故A错误;
B.乙酸乙酯不溶于饱和碳酸钠溶液,乙酸能被碳酸钠溶液吸收,然后用分液的方法分离,故B正确;
C.乙烯被酸性高锰酸钾氧化为二氧化碳气体,引入新的杂质,故C错误;
D.乙醇和水互溶,分离应用蒸馏的方法,不能用过滤的方法,故D错误.
故选B.
点评:本题考查物质的分离、提纯,题目难度不大,本题注意根据物质的性质的异同选择分离方法.
本题难度:一般
5、选择题 AlCl3溶液中Cl-的物质的量浓度为6 moL/L,则AlCl3溶液的物质的量浓度为
A.1.0 mol·L-1
B.2 mol·L-1
C.3 mol·L-1
D.18 mol·L-1
参考答案:B
本题解析:
本题难度:困难