1、选择题 由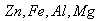 四种金属中的两种组中的混合物10 g,与足量的盐酸反应产生的
四种金属中的两种组中的混合物10 g,与足量的盐酸反应产生的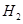 在标准状况下为11.2L,则混合物中一定含有的金属是(?)
在标准状况下为11.2L,则混合物中一定含有的金属是(?)
参考答案:C
本题解析:产生11.2LH2需要锌32.5g,铁28g,铝9g,镁12g,根据平均值思想,混合物中的两种金属需要量应分别小于和大于10g,而小于混合物10g的只有铝,故一定有铝,
故选C.
点评:本题考查混合物的计算,题目难度不大,注意平均值法的利用.
本题难度:简单
2、简答题 某试样X由氧化亚铁和氧化铜组成.取质量相等的两份试样按下图进行实验:
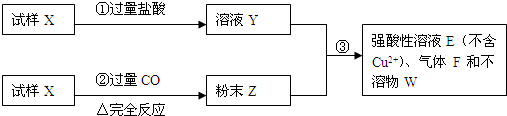
(1)请写出步骤①中发生的全部反应的离子方程式______
(2)请写出步骤③中发生的全部反应的离子方程式______.
(3)若全部的溶液Y和全部的粉末Z充分反应生成不溶物W的质量为32g,气体F在标准状况下体积为5.6L,所得溶液的体积为200mL,则每份试样X的质量______g,所得溶液E中Fe2+的物质的量浓度为______mol/L.
参考答案:(1)金属氧化物和酸反应生成盐和水,金属氧化物、若电解质写化学式,强电解质写离子式,所以氧化亚铁和盐酸、氧化铜和盐酸反应的离子方程式分别为:FeO+2H+=Fe2++H2O;CuO+2H+=Cu2++H2O.
所以溶液Y为氯化亚铁和氯化铜的混合溶液.
故答案为:FeO+2H+=Fe2++H2O;CuO+2H+=Cu2++H2O.
(2)因为CuO+CO?△?.?Cu+CO2,FeO+CO?△?.?Fe+CO2 ,所以固体粉末Z为Cu和Fe.铁能和铜离子发生置换反应,所以铁和铜离子发生的离子方程式为:Fe+Cu2+=Cu+Fe2+;
强酸性溶液E不含铜离子,且有气体F生成,所以铁与铜离子反应铁过量,铁还和酸反应,所以铁和酸反应的离子方程式为:Fe+2H+=Fe2++H2↑;
故答案为:Fe+Cu2+=Cu+Fe2+;Fe+2H+=Fe2++H2↑.
(3)溶物W为铜,铜有两部分来源,一部分是CO还原出的铜,一部分为铁与铜离子反应置换出的铜,所以以W的一半计算试样中的氧化铜的质量;
? CuO--Cu?
? 80g? 64g
?20g?16g
所以试样中氧化铜的质量为20g;
粉末Z中的铁单质,一部分和铜离子发生置换反应,一部分和酸发生置换反应,根据粉末Z中的铁单质计算试样中的氧化亚铁的质量.
Fe+Cu2+=Cu+Fe2+;
56g? 64g
14g? 16g
所以和铜离子发生置换反应的铁为14g;
Fe+2H+=Fe2++H2↑
56?22.4L?
14g? 5.6L
所以与酸反应的铁的质量是14g;
即粉末Z中铁的质量为14g+14g=28g;
FeO--Fe
72g? 56g
36g?28g
所以试样中含FeO 36g;
所以试样的质量为20g+36g=56g
最终两份试样中的氧化亚铁全部转化为Fe2+,两份试样中氧化亚铁的质量为36g×2=72g.
FeO--Fe2+
72g? 1mol
72g? 1mol
所以Fe2+的物质的量为1mol,C(Fe2+)=nV=1mol0.2L=5mol/L
故答案为:56g;5mol/L.
本题解析:
本题难度:一般
3、选择题 a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg5种金属中的一种。已知:①a、c均能与稀硫酸反应放出气体;②b与d的硝酸盐反应,置换出单质d;③c与强碱反应放出气体;④c、e在冷浓硫酸中发生钝化。由此可判断a、b、c、d、e依次为?
A.Fe Cu Al Ag Mg
B.Al Cu Mg Ag Fe
C.Mg Cu Al Ag Fe
D.Mg Ag Al Cu Fe
参考答案:C
本题解析:由(1)可判断出a、c是位于金属活动顺序中H前的金属,可能是Fe、Al、Mg中的两种。由(2)可判断出b的金属活动性大于d,即在金属活动性顺序中b在d前。由(3)可确定C为Al。由(4)可确定c、e为Al和Fe,既然c已确定为Al,则可确定e为Fe。回过头来再由(1)可知a为Mg。现在只剩下Cu、Ag两种金属尚未与字母挂联,再由(2)可知b的活动性大于d,则可确定b为Cu,d为Ag。综合以上所述,可确定a、b、c、d、e依次为 Mg、Cu、Al、Ag、Fe。故选项C符合题意。
本题难度:一般
4、选择题 现有一份单质铁和氧化铁的混合物,其物质的量共a mol,加入一定量的盐酸后固体全部溶解,收集到b mol氢气。下列有关叙述中正确的是
A.反应后的溶液中加入氯水不变色
B.反应后的溶液可继续溶解金属铜
C.原混台物中氧化铁的物质的量为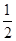 (a-b)mol
(a-b)mol
D.原混合物中单质铁的物质的量为b mol
参考答案:C
本题解析:A、铁离子的氧化性强于氢离子,所以混合物溶于水铁首先与反应中生成的氯化铁反应生成氯化亚铁,然后再与盐酸反应生成氢气。溶液是氯化亚铁溶液,亚铁离子具有还原性,所以反应后的溶液中加入氯水生成铁离子,溶液颜色变化,A不正确;B、氯化亚铁与铜不反应,因此B不正确;C、根据电子转移守恒,与H+反应生成H2的铁的物质的量等氢气的物质的量,即n(Fe)=n(H2)=bmol;其余的铁则和Fe2O3以等物质的量溶于盐酸生成FeCl2,即Fe+Fe2O3+6H+=3Fe2++3H2O,参加该反应的铁与氧化铁的物质的量为均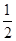 (a-b)mol,C正确;D、共含铁bmol+
(a-b)mol,C正确;D、共含铁bmol+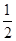 (a-b)mol=
(a-b)mol=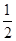 (a+b)mol,D不正确,答案选C。
(a+b)mol,D不正确,答案选C。
本题难度:简单
5、选择题 下列溶液中,常温下可以用铁罐装运的是?
A.浓盐酸
B.稀硫酸
C.浓硝酸
D.硫酸铜溶液
参考答案:C
本题解析:浓盐酸、稀硫酸、硫酸铜都可以与Fe发生化学反应而导致铁罐被腐蚀,不能用铁罐来装运。?但是Fe在常温下遇到浓硝酸 时被硝酸氧化产生一薄层致密的氧化物保护膜而阻止了内层的金属继续被氧化,从而起到了保护作用。因此常温下可以用铁罐装运的是浓硝酸。选项为C。
本题难度:简单